题目内容
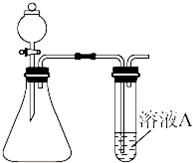
 某同学利用如图所示装置进行实验,一段时间后,水沿导管缓慢上升,下列说法错误的是
某同学利用如图所示装置进行实验,一段时间后,水沿导管缓慢上升,下列说法错误的是
- A.实验过程中气球体积会发生变化
- B.广口瓶内中液体的pH值减小
- C.广口瓶中有化合反应发生
- D.试管中不可能发生分解反应
D
分析:装置图中得知,铜丝与浓硝酸反应生成二氧化氮气体,一段时间后二氧化氮气体与广口瓶中的水反应生成硝酸和一氧化氮气体,一氧化氮和广口瓶中氧气反应又生成二氧化氮,重复反应溶解,广口瓶中呈酸性,试管内气体体积减少,液面上升,由于变化过程中有气体的生成与反应、吸收,气球体积会有所变化;浓硝酸见光分解生成二氧化氮、氧气、水;
解答:A、反应过程中有气体的生成、吸收、反应会引起装置内压强变化,气球体积会发生变化,故A正确;
B、广口瓶中吸收二氧化氮气体生成硝酸溶液PH<7,生成的一氧化氮气体会和广口瓶中的氧气反应生成二氧化氮,重复进行吸收、反应最终反应结束,故B正确;
C、广口瓶内发生反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2,故C正确;
D、试管中能发生分解反应,浓硝酸见光分解反应为,4HNO3=4NO2↑+O2↑+H2O,故D错误;
故选D.
点评:本题考查了浓硝酸的化学性质,氮氧化物的性质,掌握实验过程的分析问题,解决问题的能力.
分析:装置图中得知,铜丝与浓硝酸反应生成二氧化氮气体,一段时间后二氧化氮气体与广口瓶中的水反应生成硝酸和一氧化氮气体,一氧化氮和广口瓶中氧气反应又生成二氧化氮,重复反应溶解,广口瓶中呈酸性,试管内气体体积减少,液面上升,由于变化过程中有气体的生成与反应、吸收,气球体积会有所变化;浓硝酸见光分解生成二氧化氮、氧气、水;
解答:A、反应过程中有气体的生成、吸收、反应会引起装置内压强变化,气球体积会发生变化,故A正确;
B、广口瓶中吸收二氧化氮气体生成硝酸溶液PH<7,生成的一氧化氮气体会和广口瓶中的氧气反应生成二氧化氮,重复进行吸收、反应最终反应结束,故B正确;
C、广口瓶内发生反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2,故C正确;
D、试管中能发生分解反应,浓硝酸见光分解反应为,4HNO3=4NO2↑+O2↑+H2O,故D错误;
故选D.
点评:本题考查了浓硝酸的化学性质,氮氧化物的性质,掌握实验过程的分析问题,解决问题的能力.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
如图1所示是实验室中制取气体的一种简易装置.

(1)请简述检验它的气密性的方法 .
(2)利用如图1所示装置可以制取(填反应物状况及发生反应是否需要的条件) 气体.
(3)某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.已知16.9%稀硝酸的密度为1.10g/cm3,则其物质的量浓度为 (计算结果保留两位小数).用若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有玻璃棒、烧杯和 .
(4)当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是 .B装置烧杯中液体的作用是 .当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(5)已知下列反应可以发生:Fe2O3+3KNO3+4KOH
2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是 .
a.HNO3的氧化性比KNO3弱
b.反应的温度不够
c.HNO3的热稳定性比KNO3差
d.FeO42-不能存在于酸性溶液中
(6)现有仪器和药品:试管和胶头滴管,0.1mol/L KSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/L KI溶液、氯水等.请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写表中实验报告:

(1)请简述检验它的气密性的方法
(2)利用如图1所示装置可以制取(填反应物状况及发生反应是否需要的条件)
(3)某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.已知16.9%稀硝酸的密度为1.10g/cm3,则其物质的量浓度为
(4)当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是
(5)已知下列反应可以发生:Fe2O3+3KNO3+4KOH
| 高温 |
a.HNO3的氧化性比KNO3弱
b.反应的温度不够
c.HNO3的热稳定性比KNO3差
d.FeO42-不能存在于酸性溶液中
(6)现有仪器和药品:试管和胶头滴管,0.1mol/L KSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/L KI溶液、氯水等.请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写表中实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试 管中滴入几滴KSCN溶液. |
|
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
如图1所示是实验室中制取气体的一种简易装置.

(1)请简述检验它的气密性的方法.
(2)利用如图1所示装置制取气体时,可适用的反应条件和反应物状态为 .
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.
(3)已知16.9%稀硝酸的密度为1.10g?cm-3,则其物质的量浓度为 (计算结果保留两位小数).若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有量筒、玻璃棒、烧杯、 .
(4)实验开始时,先打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是 .B装置烧杯中液体的作用是 .当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(5)现有仪器和药品:试管和胶头滴管,0.1mol?L-1 KSCN溶液、0.2mol?L-1酸性KMnO4溶液、0.1mol?L-1 KI溶液、氯水等.请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告.

(1)请简述检验它的气密性的方法.
(2)利用如图1所示装置制取气体时,可适用的反应条件和反应物状态为
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.
(3)已知16.9%稀硝酸的密度为1.10g?cm-3,则其物质的量浓度为
(4)实验开始时,先打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是
(5)现有仪器和药品:试管和胶头滴管,0.1mol?L-1 KSCN溶液、0.2mol?L-1酸性KMnO4溶液、0.1mol?L-1 KI溶液、氯水等.请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告.
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液. | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
某同学用如图所示的装置来制取和探究气体(H2、O2、Cl2、SO2、NO2)的性质.
 (1)装药品前,应先进行的操作
(1)装药品前,应先进行的操作
(2)如果用该装置制取H2、O2,可选用的试剂组合是 (填序号).
(3)五种气体中,可同时采用如图所示两种收集装置收集的气体是 .
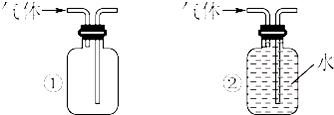
(4)两同学分别利用该装置制取并探究气体性质.同学甲利用亚硫酸钠固体与硫酸反应制取SO2,同学乙用高锰酸钾和盐酸制取氯气.请回答:
①写出亚硫酸钠固体与硫酸反应制取SO2的化学方程式: .
②若溶液A为溴水,通入SO2后现象是 ;若溶液A为溴化钠溶液,通入氯气时反应的离子方程式为 .实验证明Br2、SO2和Cl2氧化性由大到小的顺序为 .
③两同学想比较Cl2和SO2漂白速率的快慢,A溶液选取的是相同量的品红溶液.同时制取气体Cl2和SO2,观察品红溶液褪色的时间,比较褪色的快慢,该方法存在的缺陷为 .两同学还想比较Cl2和
SO2漂白的差异性,还需要的操作和可能观察到的现象为 .
 (1)装药品前,应先进行的操作
(1)装药品前,应先进行的操作(2)如果用该装置制取H2、O2,可选用的试剂组合是
| H2 | O2 | |
| ① | Zn、稀盐酸 | KClO3、MnO2 |
| ② | Zn、稀硫酸 | H2O2溶液、MnO2 |
| ③ | Zn、稀硝酸 | KMnO4 |
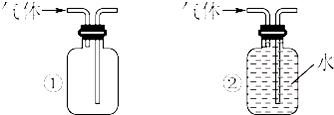
(4)两同学分别利用该装置制取并探究气体性质.同学甲利用亚硫酸钠固体与硫酸反应制取SO2,同学乙用高锰酸钾和盐酸制取氯气.请回答:
①写出亚硫酸钠固体与硫酸反应制取SO2的化学方程式:
②若溶液A为溴水,通入SO2后现象是
③两同学想比较Cl2和SO2漂白速率的快慢,A溶液选取的是相同量的品红溶液.同时制取气体Cl2和SO2,观察品红溶液褪色的时间,比较褪色的快慢,该方法存在的缺陷为
SO2漂白的差异性,还需要的操作和可能观察到的现象为