��Ŀ����
����Ŀ����֪���ȵ�������ˮ������Ӧ����������������ͼ��ʾװ�ý������ڸ�������ˮ������Ӧ��ʵ��,���üķ����ռ����������ɵ���������ش��������⡣
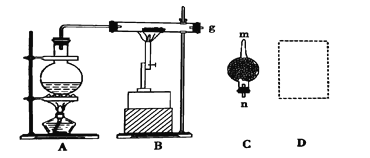
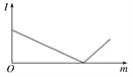
(1)д�����ڸ�������ˮ������Ӧ�Ļ�ѧ����ʽ: _____________________
(2)�����C��ʢ�ŵ�ҩƷ��________������ܵ�_______(����m������n��)����g���������ӡ�
(3)�����üķ��������ռ���������������?����ʵ��������������_____
(4)���ռ�����״���µ�H2 11.2 L,��μӷ�Ӧ�����۵�����Ϊ____________g��
(5)��������������16 gʱ������H2������Ϊ____________g��
���𰸡�3Fe+4H2O(g)= Fe3O4+4H2�� ��ʯ�� n ��Ĵָ��ס�Թܿڡ��Թܿ����ϣ������ƾ��ƻ��棬�ɿ�Ĵָ������������˵���ռ��������������� 21 2
��������
(1) ���ڸ�������ˮ������Ӧ����������������������
(2)�����CΪ����δ��Ӧ��ˮ���������ü�ʯ�Ҹ��Ϊ��֤����Ч��������������Ϊ����ܴ�ڽ���С�ڳ���
(3)�ռ��������ڵ�ȼʱ�б�����������֤�ռ�����Ϊ������
(4) ���ݷ���ʽ���㣻
(5)��ӦǰΪFe����Ӧ��Ϊ����������������ӵ�ΪO��������
(1) ���ڸ�������ˮ������Ӧ��������������������������ʽΪ3Fe+4H2O(g)= Fe3O4+4H2����
(2)�����CΪ����δ��Ӧ��ˮ���������ü�ʯ�Ҹ��Ϊ��֤����Ч��������������Ϊ����ܴ�ڽ���С�ڳ�����n��m����
(3)�����ܹ���������Ӧ�����ռ��������ڵ�ȼʱ�б������������֤�ռ�����Ϊ����������IJ���������Ϊ����Ĵָ��ס�Թܿڣ��Թܿ����ϣ������ƾ��ƻ��棬�ɿ�Ĵָ������������˵���ռ�����������������
(4) ��״����H2Ϊ11.2 L����0.5mol�����ݷ���ʽ3Fe+4H2O(g)= Fe3O4+4H2����֪���μӷ�Ӧ��FeΪ0.375mol��m=nM=0.375mol��56g/mol=21g��
(5)��ӦǰΪFe����Ӧ��Ϊ����������������ӵ�ΪO��������������������16 gʱ��n��O��=1mol������ԭ���غ��֪����Ӧ��Fe3O4Ϊ0.25mol�����������������ʵ���Ϊ1mol��������Ϊ2g��

 Ӣ��СӢ������Ĭдϵ�д�
Ӣ��СӢ������Ĭдϵ�д� �����ҵ���������ͯ������ϵ�д�
�����ҵ���������ͯ������ϵ�д�����Ŀ����һ����ɫ�����ĩ����FeCl3��CaCO3��Na2SO4��KCl��Ba(NO3)2�еļ���������ɣ�ȡ��Ʒ��������ʵ�飨�������й����У��ܷ�Ӧ������֮��ķ�Ӧǡ����ȫ����

��1����������÷��뷽������___��Ҫ�Ӳ�������á���ɫ��Һ������ȡ�ܼ������÷��뷽������___��
��2��д��ʵ������з�����ѧ��Ӧ�����ӷ���ʽ��___����___��
��3�������ĩ��һ�������ڵ������ǣ��ѧʽ����ͬ��___������ȷ���Ƿ���ڵ�������___��
��4���������ĩ���ܵ���������±������Բ�������Ҳ�����ٲ��䣩��___
��� | ��ѧʽ |
�� | |
�� | |
��5�����һ��ʵ�飬��һ��ȷ����������ɣ�����ʵ�����������ͽ��ۡ�___