题目内容
15. 某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.(1)写出正极反应式Cl2+2e-═2Cl-
(2)原电池工作时溶液中出现的现象交换膜左侧溶液大量白色沉淀生成
(3)当电路中转移0.01mol e-时,交换膜左侧溶液中约减少0.02 mol离子.
分析 根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
(1)正极上氯气得电子;
(2)放电时,交换膜左则的氢离子向正极移动,氯离子与银离子生成氯化银沉淀;
(3)根据电池总反应判断.
解答 解:根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
(1)正极上氯气得电子生成氯离子,其电极反应为:Cl2+2e-═2Cl-,故答案为:Cl2+2e-═2Cl-;
、(2)放电时,交换膜左侧溶液中生成银离子,银离子与氯离子反应生成氯化银沉淀,所以交换膜左侧溶液中有大量白色沉淀生成,
故答案为:交换膜左侧溶液大量白色沉淀生成;
(3)放电时,当电路中转移0.01mol e-时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,同时会有0.01molAg失去0.01mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.01mol,则交换膜左侧溶液中约减少0.02mol离子,
故答案为:0.02.
点评 本题考查了原电池原理的应用及沉淀反应,注意把握原电池原理及正负极的判断和电极方程式的书写,利用电子及电荷守恒来解决原电池中有关计算的问题,题目难度中等.

练习册系列答案
相关题目
5.类推是学习和研究化学的重要思维方法.下列类推结论正确的是( )
| A. | 向Ba(NO3)2溶液中通入CO2不产生白色沉淀,则通入SO2也不产生白色沉淀 | |
| B. | 电负性:C<N<O,则第一电离能:C<N<O | |
| C. | 乙醛能被新制Cu(OH)2氧化,则乙醛也能被溴水氧化 | |
| D. | HBr的沸点小于HI的沸点,则HBr的稳定性小于HI的稳定性 |
6.有关物质性质及用途的说法,正确的是( )
| A. | 甲烷与氯气在光照的条件下制取纯净的一氯甲烷 | |
| B. | 常见的塑料有:①聚乙烯 ②聚丙烯 ③聚氯乙烯 ④聚苯乙烯,其分子内部都含有双键 | |
| C. | 牡丹籽油是一种优良的植物油脂,它可使酸性高锰酸钾溶液褪色 | |
| D. | 等质量的乙烯和聚乙烯充分燃烧所需氧气的量不相等 |
3.反应:2SO2+O2?2SO3在一定条件下的密闭容器中进行.已知反应的某一时间SO2、O2、SO3浓度分别为0.1mol•L-1、0.1mol•L-1、0.2mol•L-1,当达到平衡时,可能存在的数据为( )
| A. | SO2为0.3 mol•L-1、O2为0.2 mol•L-1 | |
| B. | SO3SO2各为0.15 mol•L-1 | |
| C. | O2为0.05 mol•L-1 | |
| D. | SO3为0.3 mol•L-1 |
10.下列说法中,正确的是( )
| A. | 要检验某溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 实验室制取乙烯时,常伴有刺激性气味的气体产生,说明部分乙醇被氧化为乙醛 | |
| C. | 凡是能发生银镜反应的物质一定是醛或羧酸中的甲酸 | |
| D. | 向苯酚钠溶液中通入过量的二氧化碳气体时,生成物不可能是碳酸钠 |
7.下列说法错误的是( )
| A. | 作半导体材料的元素大多数位于周期表中金属元素和非金属元素的交界处 | |
| B. | 农药中常含有的元素通常在元素周期表的右上方区域内 | |
| C. | 构成催化剂的元素通常在元素周期表的左下方区域内 | |
| D. | 在周期表过渡元素中寻找作耐高温和耐腐蚀的合金材料的元素 |
4.下列叙述正确的是( )
| A. | 硅酸、氯化铁均为胶体 | B. | 醋酸、蔗糖均属于电解质 | ||
| C. | 水玻璃、氯水均为混合物 | D. | 氧化钙、氧化铝均为碱性氧化物 |
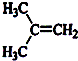
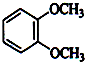
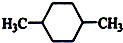
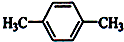
 如图所示(图中部分仪器未画出)有一容积为300mL的注射器,与蒸馏烧瓶(500mL)相连接,烧瓶中有0.384g Cu片,现向烧瓶中加入18mL 2.5mol•L-1的稀HNO3溶液,并立即用锡箔包住橡皮塞封住瓶口.(气体体积视为标准状况下的)试回答:
如图所示(图中部分仪器未画出)有一容积为300mL的注射器,与蒸馏烧瓶(500mL)相连接,烧瓶中有0.384g Cu片,现向烧瓶中加入18mL 2.5mol•L-1的稀HNO3溶液,并立即用锡箔包住橡皮塞封住瓶口.(气体体积视为标准状况下的)试回答: