题目内容
【题目】在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) ![]() zC(g),图①表示200 ℃时容器中A、B、C的物质的量随时间的变化,图②表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
zC(g),图①表示200 ℃时容器中A、B、C的物质的量随时间的变化,图②表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
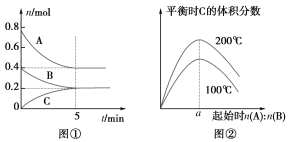
A. 200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 由图②知反应xA(g)+yB(g) ![]() zC(g)的ΔH>0,且a=2
zC(g)的ΔH>0,且a=2
C. 若在图①所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D. 200 ℃,6 min时向容器中充入2 mol A和1 mol B,重新达到平衡时,A的体积分数大于0.5
【答案】B
【解析】
A. 根据![]() =
= ![]() =
= ![]() 计算B的反应速率;
计算B的反应速率;
B. 由图②可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应方向移动,据此判断反应热效应;在一定的温度下A、B起始物质的量之比刚好等于平衡时化学方程式的计量数之比,则平衡时生成物C的体积分数最大,由图①判断200℃ A、B的起始物质的量,据此计算a的值;
C. 恒温恒容条件下,通入氦气反应混合物的浓度不变,平衡不移动;
D. 200℃时,向容器中充入2 mol A和1 mol B达到平衡时,等效为原平衡增大压强,根据图①中A、B、C的物质的量变化量之比等于化学计量数之比确定x、y、z,据此判断增大压强对该平衡的影响效果,得出A的体积分数2变化情况。
A.由图①可知,200℃时5 min达到平衡,平衡时B的物质的量变化量为0.4 mol-0.2 mol = 0.2 mol,故![]() (B)=
(B)= ![]() = 0.02 molL-1min-1,故A项错误;
= 0.02 molL-1min-1,故A项错误;
B.由图②可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,即△H>0,图①可知,200℃时平衡时,A的物质的量变化量为0.8 mol-0.4 mol=0.4 mol,B的物质的量变化量为0.2 mol,在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,A、B的起始物质的量之比 = 0.4 mol:0.2 mol = a = 2,故B项正确;
C.恒温恒容条件下,通入氦气反应混合物的浓度不变,平衡不移动,故v(正)=v(逆),故C项错误;
D.由图①可知,200℃时平衡时,A、B、C的物质的量变化量分别为0.4 mol、0.2 mol、0.2 mol,因各物质的物质的量之比等于化学计量数之比,故x:y:z = 0.4mol:0.2mol:0.2mol = 2:1:1,平衡时A的体积分数为![]() = 0.5,200℃时,向容器中充入2 mol A和1 mol B达到平衡等效为原平衡增大压强,平衡向正反应移动,A的物质的量减小,则达到平衡时,A的体积分数小于0.5,故D项错误;
= 0.5,200℃时,向容器中充入2 mol A和1 mol B达到平衡等效为原平衡增大压强,平衡向正反应移动,A的物质的量减小,则达到平衡时,A的体积分数小于0.5,故D项错误;
答案选B。

【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D