题目内容
向18.4 g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3 g沉淀。另取等质量的合金,使其与一定量的氯气恰好完全反应,则氯气的体积在标准状况下为
| A.7.84L | B.6.72L | C.4.48L | D.无法计算 |
A
解析试题分析:设铁为xmol,铜为ymol,依题意有:
56x+64y=18.4
107x+98y=30.3
解之得:x=0.1mol y=0.2mol
因此最大终形成:0.1mol的FeCl3和0.2mol的CuCl2
其中的氯都来自于氯气,因此
则氯气的体积在标准状况下为:V(Cl2)=0.35mol×22.4L/mol=7.84L
考点:原子守恒。

练习册系列答案
相关题目
下列化学用语书写正确的是( )
A. 的离子结构示意图: 的离子结构示意图: |
B.CH4分子的比例模型: |
C.四氯化碳的电子式: |
D.用电子式表示氯化氢分子的形成过程: |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,2.24 L水中所含电子总数为NA |
| B.1 L 0.2 mol·L-1硫酸铁溶液中含有的SO42-数为0.2NA |
| C.苯和苯甲酸混合物1 mol,完全燃烧消耗O2的分子数为7.5NA |
| D.标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA |
NA表示阿伏加德罗常数,以下各物质所含分子数最多的是( )
| A.标准状况下11.2 L氯气 | B.17g氨气 |
| C.0.8mol氧气 | D.4℃时,36mL的H2O |
下列与阿伏加德罗常数的值(NA)有关的说法正确的是( )
| A.NA个Fe(OH)3胶体粒子的质量为107g |
| B.8.0 gCu2S和CuO的混合物中含有铜原子数为0.1NA |
| C.标准状况下,2.24 L Cl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA |
| D.2.3gNa与氧气完全反应,反应中转移的电子数介于0.1 NA到0.2 NA之间 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA |
| B.78 g 苯含有C="C" 双键的数目为3NA |
| C.1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目为NA |
| D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
用NA表示阿伏伽德罗常数的值,下列叙述不正确的是
| A.18g重水含有10NA中子 | B.10.6gNa2CO3固体有0.1NAC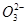 |
| C.6.4gCu失去的电子数可能为0.1NA | D.1mo1H2C2O4能消耗2NAOH— |
Ⅰ、甲同学欲配制0.55 mo1·L—1 的NaOH溶液200mL(存在200mL容量瓶)。称量操作如下:
①先用托盘天平称量烧杯的质量。称量前先调节天平零点。用“↓”表示在天平右盘上放置砝码,用“↑”表示从天平右盘上取下砝码。取用砝码情况和游码读数如下:
| 砝码质量 | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 | 先↓后↑ | ↓ | 先↓后↑ | ↓ | 先↓后↑ |
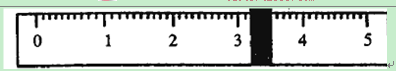
烧杯的质量为 g。
②称量烧杯和NaOH固体的质量。再在天平右盘上放置 g砝码,将游码的位置移到 g的位置,往烧杯中逐渐加入NaOH固体,直到天平达到平衡。
Ⅱ、乙同学欲用用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解 ④ 转移
⑤洗涤 ⑥定容 ⑦摇匀
回答下列问题
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (请填编号)(从下列中选用 A.10ml B.25ml C.50ml D.100ml)
(2)定容时俯视溶液的凹液面对所配制的稀硫酸浓度有何影响
(用偏大、偏小、无影响填写)
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,2.24 L CHCl3的原子总数为0.1 NA |
| B.4.2 g C3H6中含有的碳碳双键数一定为0.1 NA |
| C.1 mol —OH中电子数为10 NA |
| D.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA |