题目内容
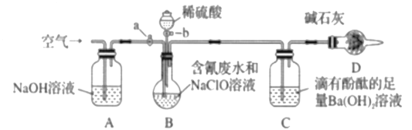
【题目】将50mL某AlCl3溶液加入30mL1mol/LNaOH溶液或50mL1.8mol/LNaOH溶液中,均能得到0.78g白色沉淀,则此AlCl3溶液的浓度是()
A.0.5 mol/LB.0.4 mol/LC.0.3 mol/LD.0.2 mol/L
【答案】A
【解析】
由信息可知,加到30mL1mol/LNaOH溶液中只发生Al3++3OH-=Al(OH)3↓,加到50mL1.8mol/LNaOH溶液中发生Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,以此来计算解答。
0.78gAl(OH)3沉淀的物质的量是n[Al(OH)3]=0.78g÷78g/mol=0.01mol。
①从反应开始至加入到30mL![]() NaOH溶液时,溶液中OH-的物质的量为n(OH-)=1mol/L×0.03L=0.03mol,只发生反应:Al3++3OH-=Al(OH)3↓,碱完全反应,则根据Al元素守恒可知该溶液的物质的量浓度c(AlCl3)>0.01mol÷0.05L=0.2mol/L;
NaOH溶液时,溶液中OH-的物质的量为n(OH-)=1mol/L×0.03L=0.03mol,只发生反应:Al3++3OH-=Al(OH)3↓,碱完全反应,则根据Al元素守恒可知该溶液的物质的量浓度c(AlCl3)>0.01mol÷0.05L=0.2mol/L;
②由加到50mL 1.8mol/LNaOH溶液中发生Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,设此AlCl3溶液的溶质的物质的量为x,则根据Al3++3OH-=Al(OH)3↓可知xmolAl3+反应消耗OH-的物质的量是3xmol,反应产生的Al(OH)3沉淀的物质的量是xmol,发生反应Al(OH)3+OH-=AlO2-+2H2O的Al(OH)3沉淀的物质的量是(x-0.01)mol,消耗OH-的物质的量是(x-0.01)mol,根据消耗的碱的物质的量可知,3x+(x-0.01)=0.05×1.8,解得x=0.025mol,故该AlCl3溶液的浓度为c(AlCl3)= 0.025mol÷0.05L=0.5mol/L,
由①②可知,此AlCl3溶液的浓度为0.5mol/L,故合理选项是A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】利用某冶金行业产生的废渣(主要含![]() ,还有少量
,还有少量![]() 、
、![]() 等杂质)可以制备
等杂质)可以制备![]() ,生产流程如下:
,生产流程如下:
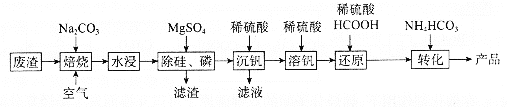
已知:![]() 微溶于水、溶于碱生成
微溶于水、溶于碱生成![]() (加热生成
(加热生成![]() ),具有强氧化性。向
),具有强氧化性。向![]() 溶液中加酸,不同
溶液中加酸,不同![]() 对应的主要存在形式如表:
对应的主要存在形式如表:
|
| 10.6~12 | 约8.4 | 3~8 | 约2 | <1 |
存在形式 |
|
|
|
|
|
|
回答下列问题:
(1)“焙烧”后V元素转化为![]() ,
,![]() 元素转化为________(写化学式)。
元素转化为________(写化学式)。
(2)欲除尽磷元素(即![]() ),最终溶液中
),最终溶液中![]() 的浓度至少为________
的浓度至少为________![]() (已知
(已知![]() )。
)。
(3)“沉钒”过程中,![]() 由8.5到5.0发生反应的离子方程式为________;最终需要控制
由8.5到5.0发生反应的离子方程式为________;最终需要控制![]() 约为________;“沉钒”最终得到的主要含钒物质是________(写化学式)。
约为________;“沉钒”最终得到的主要含钒物质是________(写化学式)。
(4)“还原”和“转化”过程中主要反应的离子方程式分为________、________。
【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:2SO3(g)![]() 2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:
2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物 质 的量 /mol | 平衡时反应中的能量变化 | ||
SO3 | SO2 | O2 | ||
① | 2 | 0 | 0 | 吸收热量akJ |
② | 0 | 2 | 1 | 放出热 量 bkJ |
③ | 4 | 0 | 0 | 吸收热量ckJ |
下列叙述正确的是( )
A. 达平衡时O2的体积分数:①>③
B. 热量关系:a一定等于b
C. ①②③ 反应的平衡常数:③>①>②
D. ①中的密度不再改变时说明反应已达到平衡状态
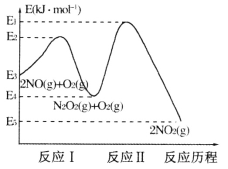
【题目】研究NOx、CO、SO2等大气污染气体的治理,对保护环境有重要的意义。回答下列问题:
(1)NOx与CO反应生成无污染气体的相关热化学方程式如下:
①NO2(g)+CO(g)![]() CO2(g)+NO(g) ΔH1=234.0kJ·mol1
CO2(g)+NO(g) ΔH1=234.0kJ·mol1
②4NO(g)![]() 2NO2(g)+N2(g) ΔH2=291.8kJ·mol1
2NO2(g)+N2(g) ΔH2=291.8kJ·mol1
反应③2NO2(g)+4CO(g)![]() N2(g)+4CO2(g)的ΔH3=___kJ·mol1,有利于提高该反应NO2平衡转化率的条件是___(填标号)。
N2(g)+4CO2(g)的ΔH3=___kJ·mol1,有利于提高该反应NO2平衡转化率的条件是___(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
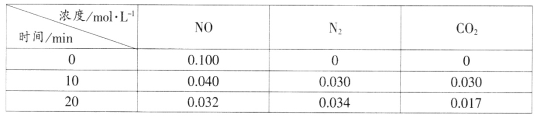
(2)在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应:2NO2(g)+4CO(g)![]() N2(g)+4CO2(g),测得相关数据如下:
N2(g)+4CO2(g),测得相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2)/mol·L1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/mol·L1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①其他条件不变,若不使用催化剂,则0~5minNO2的转化率将___(填“变大”、“变小”或“不变”)。
②以下表述能说明该反应已达到平衡状态的是___。
A.CO的反应速率为N2的4倍
B.气体的颜色不再变化
C.化学平衡常数K不再变化
D.混合气的压强不再变化
③该温度下反应的化学平衡常数K=__(保留两位有效数字)。
④在20min时,保持温度不变,继续向容器中再加入2.0molNO2和2.0molN2,则化学平衡__移动(填“正向”、“逆向”或“不”)。
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。
①CH4还原NO2反应的化学方程式为___。
②在相同条件下,选用A、B、C三种不同催化剂进行反应,生成N2的物质的量与时间变化如图图1所示,其中活化能最大的是___[Ea(A)、Ea(B)、Ea(C)分别表示三种催化剂下该反应的活化能]。
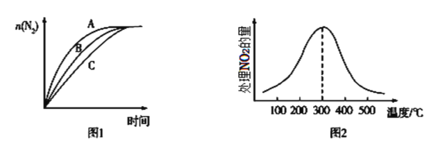
③在催化剂A作用下,测得相同时间内处理NO2的量与温度的关系如图2所示,曲线先增大后减小的可能原因是___。