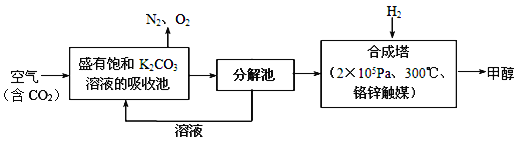
题目内容
【题目】已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为 。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)写出与BD2互为等电子体的C3-的结构式 。
(4)E+的核外电子排布式为 ,下图是D、E形成的某种化合物的晶胞结构示意图,该晶体1个晶胞中阳离子的个数为 。

(5)向E的硫酸盐溶液中通入过量的CA3,可生成[E(CA3)4]2+配离子,1 mol [E(CA3)4]2+中含有σ键的数目为 。
【答案】(1)sp2 (2)NH3分子间能形成氢键 (3)[N=N=N]-
(4)1s22s22p63s23p63d10 4
(5)16mol(或16×6.02×1023)
【解析】
试题分析:根据题意知,B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B为碳元素;D原子有2个未成对电子,A、B、D三种元素组成的一种化合物M为甲醛,原子半径大小为B>C>D>A,则A为氢元素,D为氧元素,C为氮元素; E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满,则E为铜元素。(1)甲醛的结构式为![]() ,分子中碳元素原子轨道的杂化类型为sp2;(2)化合物NH3的沸点比化合物CH4的高,其主要原因是NH3分子间能形成氢键;(3)与CO2互为等电子体的N3-的结构式为[N=N=N]-;(4)铜为29号元素,Cu+的核外电子排布式为1s22s22p63s23p63d10,根据O、Cu形成的某种化合物的晶胞结构示意图利用分摊法确定,该晶体1个晶胞中阳离子的个数为8×1/8+1=2;(5)向硫酸铜溶液中通入过量的NH3,可生成[Cu (NH3)4]2+配离子,在[Cu(NH3)4]2+中四个NH3通过配位键与Cu2+结合,在每个NH3中含有3个共价键,所以在阳离子[Cu(NH3)4]2+中含有的共价键为3×4+4=16.因此1mol该配合物中含有σ键的数目为16mol(或16×6.02×1023)。
,分子中碳元素原子轨道的杂化类型为sp2;(2)化合物NH3的沸点比化合物CH4的高,其主要原因是NH3分子间能形成氢键;(3)与CO2互为等电子体的N3-的结构式为[N=N=N]-;(4)铜为29号元素,Cu+的核外电子排布式为1s22s22p63s23p63d10,根据O、Cu形成的某种化合物的晶胞结构示意图利用分摊法确定,该晶体1个晶胞中阳离子的个数为8×1/8+1=2;(5)向硫酸铜溶液中通入过量的NH3,可生成[Cu (NH3)4]2+配离子,在[Cu(NH3)4]2+中四个NH3通过配位键与Cu2+结合,在每个NH3中含有3个共价键,所以在阳离子[Cu(NH3)4]2+中含有的共价键为3×4+4=16.因此1mol该配合物中含有σ键的数目为16mol(或16×6.02×1023)。