��Ŀ����
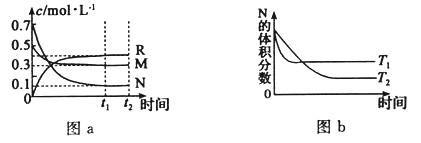
����Ŀ����ij�¶��£�ijһ�ܱ������У�M��N��R��������Ũ�ȵı仯��ͼa��ʾ���������������䣬���¶ȷֱ�ΪT1��T2ʱ��N�����������ʱ���ϵ��ͼb��ʾ�������н�����ȷ����
A���÷�Ӧ���Ȼ�ѧ����ʽM��g��+3N��g��![]() 2R��g����H>0
2R��g����H>0
B���ﵽƽ����������������䣬��С���������ƽ�����淴Ӧ�����ƶ�
C���ﵽƽ����������������䣬�����¶ȣ������淴Ӧ�ٶȾ�����M��ת���ʼ�С
D���ﵽƽ����������������䣬ͨ��ϡ�����壬ƽ��һ��������Ӧ�����ƶ�
���𰸡�C
��������
���������A����ͼa�ɵó�M��NΪ��Ӧ�RΪ���������c֮�ȿ�֪��ѧ������֮�ȣ��÷�ӦΪM��g��+3N��g��![]() 2R��g������ͼb��Ҳ����T1��T2�������¶ȣ�N������������ƽ�������ƶ����ʸ÷�ӦΪ���ȷ�Ӧ����H��0��A����B����С�����������������ѹǿ��ƽ�������ƶ���B����C�������¶ȣ�v����v�������ƽ�������ƶ���M��ת���ʼ�С��C��ȷ��D�������ں��º��ݵ�������ͨ��ϡ�����壬��ƽ�ⲻ�ƶ���D����ѡC��
2R��g������ͼb��Ҳ����T1��T2�������¶ȣ�N������������ƽ�������ƶ����ʸ÷�ӦΪ���ȷ�Ӧ����H��0��A����B����С�����������������ѹǿ��ƽ�������ƶ���B����C�������¶ȣ�v����v�������ƽ�������ƶ���M��ת���ʼ�С��C��ȷ��D�������ں��º��ݵ�������ͨ��ϡ�����壬��ƽ�ⲻ�ƶ���D����ѡC��

��ϰ��ϵ�д�
�����Ŀ
