题目内容
某温度时,在2 L容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如下图所示.
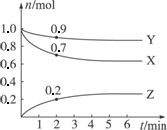
(1)由图中数据分析,该反应的化学方程式为________.
(2)反应开始至2 min,Z的平均反应速率为________.
(3)判断:第5分钟时,反应是否达到平衡?________,第5分钟时,Z的生成速率比Z的消耗速率________(填“大”“小”或“相等”).
解析:
|
答案:(1)3X+Y 思路解析:本题借助于图象考查对化学反应速率、化学平衡的理解和应用. 在相同时间内,物质的量变化之比等于化学计量数之比. Δn(X)∶Δn(Y)∶Δn(Z)=(1.0-0.7)∶(1.0-0.9)∶(0.2-0)=3∶1∶2,故该反应的化学计量数之比为3∶1∶2. 又因为反应后的某个时刻开始,各物质的物质的量都不再变了,说明该反应是可逆反应,并且在该时刻建立了化学平衡.即至少在第3分钟之前,反应正在进行,尚未达到平衡;第5分钟时,各物质的量不变,达到平衡状态,v(正)=v(逆). 绿色通道:图象也是一种表达事物的符号,分析图象及其变化特点,可以得到事物变化的实质和规律. 关于反应速率和反应限度的判断,可以借助于图象先从曲线的变化趋势——物质的量减少的是反应物,增加的是生成物;再用“相同时间内,物质的量变化之比,就可得到化学计量数之比;最后看是否是某个时刻以后,各物质的物质的量都不变了,来确定是否为可逆反应.解答此类题时,要看清图象、理清概念、把握规律、注意单位. |

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(10分)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g) + H2O(g)  CO2(g) + H2(g)的平衡常数随温度的变化如下表:
CO2(g) + H2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
试回答下列问题
(1)上述反应的正反应是 反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率_______(填“增大”、“减小”或“不变”),容器内混合气体的压强_____________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 (选填A、B、C、D)。
|
| A | B | C | D |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
(4)830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是 。
(10分)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g) + H2O(g)  CO2(g) + H2(g)的平衡常数随温度的变化如下表:
CO2(g) + H2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
试回答下列问题
(1)上述反应的正反应是 反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率_______(填“增大”、“减小”或“不变”),容器内混合气体的压强_____________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 (选填A、B、C、D)。
|
| A | B | C | D |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
(4)830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是 。
(10分)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g) + H2O(g)  CO2(g) + H2(g)的平衡常数随温度的变化如下表:
CO2(g) + H2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(1)上述反应的正反应是 反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率_______(填“增大”、“减小”或“不变”),容器内混合气体的压强_____________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 (选填A、B、C、D)。
| | A | B | C | D |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
(10分)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g) + H2O(g)  CO2(g) + H2(g)的平衡常数随温度的变化如下表:
CO2(g) + H2(g)的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
830 |
1000 |
|
平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题
(1)上述反应的正反应是 反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率_______(填“增大”、“减小”或“不变”),容器内混合气体的压强_____________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 (选填A、B、C、D)。
|
|
A |
B |
C |
D |
|
n(CO) |
1 |
2 |
3 |
0.5 |
|
n(H2O) |
5 |
2 |
3 |
2 |
|
n(CO2) |
3 |
1 |
0 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
(4)830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是 。
(10分)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g) + H2O(g)  CO2(g) + H2(g)的平衡常数随温度的变化如下表:
CO2(g) + H2(g)的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
830 |
1000 |
|
平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题
(1)上述反应的正反应是 反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率_______(填“增大”、“减小”或“不变”),容器内混合气体的压强_____________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 (选填A、B、C、D)。
|
|
A |
B |
C |
D |
|
n(CO) |
1 |
2 |
3 |
0.5 |
|
n(H2O) |
5 |
2 |
3 |
2 |
|
n(CO2) |
3 |
1 |
0 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
(4)830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是 。