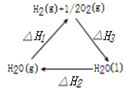
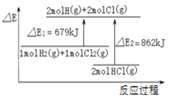
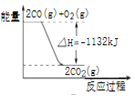
题目内容
【题目】(1)AgNO3的水溶液呈_______(填“酸”“中”或“碱”)性,原因是(用离子方程式表示)________;实验室在配制AgNO3溶液时,常先将AgNO3固体溶于较浓的硝酸中,然后用蒸馏水稀释到所需的浓度,以_________________(填“促进”或“抑制”)其水解。
(2)明矾可用于净水,原因是(用离子方程式表示)_____________,把FeCl3溶液蒸干、灼烧,最后得到的主要固体产物是______________。
(3)泡沫灭火器的灭火原理是(用离子方程式表示)________________。
(4)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示)_______________。
【答案】酸 Ag++H2O![]() AgOH+H+ 抑制 Al3++3H2O
AgOH+H+ 抑制 Al3++3H2O![]() Al(OH)3(胶体)+3H+ Fe2O3 Al3++3HCO3-=3CO2↑+Al(OH)3↓ CO32-+H2O
Al(OH)3(胶体)+3H+ Fe2O3 Al3++3HCO3-=3CO2↑+Al(OH)3↓ CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
【解析】
(1)Ag+对于的碱为AgOH,属于弱碱,故Ag+在水中会发生水解:Ag++H2O![]() AgOH+H+,导致溶液呈酸性,因Ag+在水中会发生水解,在配制AgNO3溶液时,故常先将AgNO3固体溶于较浓的硝酸中,增加溶液中H+浓度,从而抑制其水解,然后用蒸馏水稀释到所需的浓度,
AgOH+H+,导致溶液呈酸性,因Ag+在水中会发生水解,在配制AgNO3溶液时,故常先将AgNO3固体溶于较浓的硝酸中,增加溶液中H+浓度,从而抑制其水解,然后用蒸馏水稀释到所需的浓度,
故答案为:酸;Ag++H2O![]() AgOH+H+;抑制;
AgOH+H+;抑制;
(2)明矾净水的原理是利用Al3+水解生成Al(OH)3胶体,利用胶体吸附水中的杂质和悬浮颗粒,由Al3+水解生成Al(OH)3胶体的离子方程式为:Al3++3H2O![]() Al(OH)3(胶体)+3H+;FeCl3溶液蒸干过程中,Fe3+水解程度将会增加,溶液的酸度将会上升,盐酸浓度将会增加,因盐酸为易挥发性酸,故加热过程中,盐酸挥发使水解平衡正向移动,最终加热蒸干得到的固体为Fe(OH)3,然后将Fe(OH)3灼烧得到的固体为Fe2O3,
Al(OH)3(胶体)+3H+;FeCl3溶液蒸干过程中,Fe3+水解程度将会增加,溶液的酸度将会上升,盐酸浓度将会增加,因盐酸为易挥发性酸,故加热过程中,盐酸挥发使水解平衡正向移动,最终加热蒸干得到的固体为Fe(OH)3,然后将Fe(OH)3灼烧得到的固体为Fe2O3,
故答案为:Al3++3H2O![]() Al(OH)3(胶体)+3H+;Fe2O3;
Al(OH)3(胶体)+3H+;Fe2O3;
(3)泡沫灭火器灭火的原理是利用NaHCO3溶液与Al2(SO4)3溶液混合后发生强烈的相互促进双水解反应,生成二氧化碳气体、氢氧化铝固体,其离子方程式为:Al3++3HCO3-=3CO2↑+Al(OH)3↓,
故答案为:Al3++3HCO3-=3CO2↑+Al(OH)3↓;
(4)纯碱为碳酸钠,碳酸钠在溶液中会发生水解反应生成NaOH,NaOH可使油脂发生碱性水解生成醇和羧酸钠,从而达到去油污的效果,碳酸钠水解的离子方程式为:CO32-+H2O![]() HCO3-+OH-,
HCO3-+OH-,
故答案为:CO32-+H2O![]() HCO3-+OH-。
HCO3-+OH-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验结论与实验操作及现象不相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某酸雨样品中加入Ba(OH)2溶液,有白色沉淀生成 | 酸雨试样中一定含SO42- |
B | 向KI-淀粉溶液中滴入氯水,溶液变成蓝色 | I-的还原性强于Cl- |
C | 将Ba(OH)2·8H2O和NH4Cl晶体在小烧杯中混合搅拌,用手触摸烧杯外壁感觉变凉 | Ba(OH)2·8H2O与NH4Cl的反应是吸热反应 |
D | 向某盐溶液中加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口,试纸变蓝 | 该盐溶液中含有NH4+ |
A.AB.BC.CD.D