题目内容
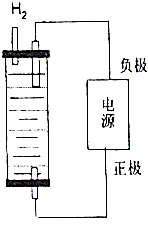
3.实验室采用简易装置模拟演示工业炼铁原理,实验装置图和实验步骤如下:
①按上图连接好装置,检查装置气密性.
②称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸.
③在完成某项操作后,点燃另外两处酒精灯.
④30min后熄灭酒精灯,关闭弹簧夹.
⑤待产物冷却至室温后,收集产物.
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物.
请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下的分解制得,盛放甲酸的仪器名称为分液漏斗,该反应的化学方程式HCOOH $→_{△}^{浓硫酸}$CO↑+H2O.
(2)实验步骤③某项操作是指检验CO纯度.
(3)实验步骤④熄灭酒精灯的顺序为Ⅲ、I、II.(填Ⅰ,Ⅱ,Ⅲ)
(4)通过查资料获取如下信息:
Ⅰ.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃.
Ⅱ.资料指出当反应温度高于710℃,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4.试分析酒精灯加热条件下生成Fe的原因是长时间集中加热使局部温度达到还原生成铁所需要的温度.
(5)已知FeO、Fe2O3、Fe3O4氧元素的质量分数分别为:22.2%、30%、27.6%.
利用仪器分析测出3种样品所含元素种类和各元素的质量分数如下表:
| 加热方式 | 产物元素组成 | 各元素的质量分数% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe.请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为12:1.(要求保留整数)
分析 (1)根据装置图可知甲酸盛放在分液漏斗中;HCOOH分解生成CO和水;
(2)CO与氧气混合加热易爆炸,所以点燃前要检验纯度;
(3)实验结束后要等试管冷却后才停止通一氧化碳,故先熄灭Ⅲ出酒精灯;应最后熄灭II中酒精灯,目的是防止多余的一氧化碳进入空气中污染环境;
(4)酒精灯的火焰平均600度,不可能达到铁稳定存在的温度,但是,在实际操作过程中,由于受热及散热的问题,会出现局部温度较高的现象;
(5)Fe、FeO、Fe2O3、Fe3O4中Fe元素的百分含量分别为100%、77.8%、70%、72.4%,结合表中的数据判断物质的组成;
(6)根据酒精灯加热得到的产物为Fe3O4和Fe,且铁元素的百分含量为74.50%,设Fe3O4的质量为x,Fe的质量为y,则$\frac{x×\frac{168}{232}+y}{x+y}$×100%=74.50%,据此计算.
解答 解:(1)根据装置图可知甲酸盛放在分液漏斗中,则盛放甲酸的仪器名称为分液漏斗;在浓硫酸加热条件下,HCOOH分解可得CO,根据质量守恒可知另一个产物为水,反应的化学方程式为HCOOH $→_{△}^{浓硫酸}$CO↑+H2O;
故答案为:分液漏斗;HCOOH $→_{△}^{浓硫酸}$CO↑+H2O;
(2)CO与氧气混合加热易爆炸,所以点燃前要检验纯度,则实验步骤③某项操作是指检验CO纯度;
故答案为:检验CO纯度;
(3)实验结束后要等试管冷却后才停止通一氧化碳,故先熄灭Ⅲ出酒精灯,是为了防止生成热的铁被空气中的氧气氧化;应最后熄灭II中酒精灯,目的是防止多余的一氧化碳进入空气中污染环境,故实验步骤④熄灭酒精灯的顺序为Ⅲ、I、II;
故答案为:Ⅲ、I、II;
(4)当反应温度高于710℃,Fe能稳定存在,酒精灯的火焰平均600度,不可能达到铁稳定存在的温度,但是,在实际操作过程中,由于受热及散热的问题,长时间集中加热会出现局部温度较高的现象,达到还原生成铁所需要的温度;
故答案为:长时间集中加热使局部温度达到还原生成铁所需要的温度;
(5)Fe、FeO、Fe2O3、Fe3O4中Fe元素的百分含量分别为100%、77.8%、70%、72.4%,酒精灯加热所得产物中Fe元素的百分含量为74.50%,混合物中至少有一个Fe元素含量大于74.50%,至少有一个Fe元素含量小于74.50%,故混合物中一定有Fe和FeO中的至少一种,也一定有Fe2O3和Fe3O4中的一种,
两种物质混合的有Fe和Fe2O3,Fe和Fe3O4,FeO和Fe2O3,FeO和Fe3O4 共4种组合,
三种物质混合的有Fe、Fe2O3和Fe3O4,FeO、Fe2O3和Fe3O4,Fe2O3、Fe和FeO,Fe3O4、Fe和FeO共4种组合,
四种物质混合的有Fe、FeO、Fe2O3和e3O4只有1种,共9种组合;
故答案为:9;
(6)根据酒精灯加热得到的产物为Fe3O4和Fe,且铁元素的百分含量为74.50%,设Fe3O4的质量为x,Fe的质量为y,则$\frac{x×\frac{168}{232}+y}{x+y}$×100%=74.50%,
解得:$\frac{x}{y}$=12:1;
故答案为:12.
点评 本题考查物质的制备实验、实验方案设计、物质含量的测定等,难度中等,明确实验原理是解本题关键,根据物质的性质分析解答,注意元素化合物知识的积累和灵活运用.

| A. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si | |
| B. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg | |
| C. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$→_{△}^{蔗糖}$Ag |
| A. | 键角是确定多原子分子立体结构(分子形状)的重要参数 | |
| B. | 通过反应物和生成物分子中键能数据可以粗略预测反应热的大小 | |
| C. | 共价键的键长越长,键能则越小,共价化合物也就越稳定 | |
| D. | 同种原子间形成的共价键键长:叁键<双键<单键 |
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 28g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA |
 制取漂白粉的氯气通过电解饱和食盐水得到.
制取漂白粉的氯气通过电解饱和食盐水得到.
 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量;O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量;O3氧化烟气中SO2、NOx的主要反应的热化学方程式为: 物质结构决定物质性质.回答下列问题:
物质结构决定物质性质.回答下列问题: ,其中心原子N的杂化方式是sp3.
,其中心原子N的杂化方式是sp3.
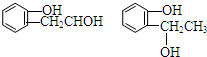 等.①遇FeCl3溶液显紫色; ②在浓硫酸催化作用下能发生消去反应.
等.①遇FeCl3溶液显紫色; ②在浓硫酸催化作用下能发生消去反应.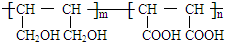 .
. 能与CH2=CHCOOH发生类似反应①的反应,生成化合物Ⅷ,写出Ⅷ的一种结构简式为
能与CH2=CHCOOH发生类似反应①的反应,生成化合物Ⅷ,写出Ⅷ的一种结构简式为 .
.