题目内容
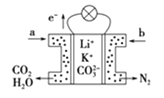
【题目】下列关于如图所示电化学装置的分析正确的是

A.若X为直流电源,Y为铜棒接正极,则Fe棒上有铜析出
B.若X为直流电源,Y为碳棒接负极,则Fe棒被保护
C.若X为电流计,Y为锌棒,则![]() 移向Fe棒
移向Fe棒
D.若X为导线,Y为铜棒,则Fe棒发生还原反应
【答案】A
【解析】
根据题中电化学装置可知,本题考查电解池,运用电解池原理分析。
A.若X为直流电源,装置为电解池,Y为铜棒接正极,则Fe接负极为电解池的阴极,阴极上铜离子得电子发生还原反应,Fe棒上析出铜,故A正确;
B.若X为直流电源,装置为电解池,Y为碳棒接负极,则Fe接正极为电解池的阳极,发生氧化反应被腐蚀,故B错误;
C.若X为电流计,装置为原电池,Y为锌棒,活泼金属Zn作负极,阴离子![]() 移向负极Zn,故C错误;
移向负极Zn,故C错误;
D.若X为导线,装置为原电池,Y为铜棒,活泼金属Fe作负极,Fe棒发生氧化反应,故D错误;
答案选A。

【题目】某课外小组以苯酚、苯和乙醇性质的比较为例,分析与实验探究有机化合物分子中的基团与性质的关系,以及基团之间存在相互影响。
(1)苯酚、苯和乙醇物理性质比较:以水溶性为例
乙醇 | 苯 | 苯酚 | |
水溶性 | 与水以任意比互溶 | 不溶于水 | 室温下,在水中溶解度是9.3g,当温度高于65℃时,能与水混溶 |
试分析苯酚、苯和乙醇水溶性差异的原因______。
(2)实验发现苯不和氢氧化钠反应,理论计算与实验发现:室温下苯酚的饱和溶液pH≈5,此时所测蒸馏水pH在5~6。考虑到空气中二氧化碳的影响,该小组认为需进一步实验以确认苯酚的酸性。
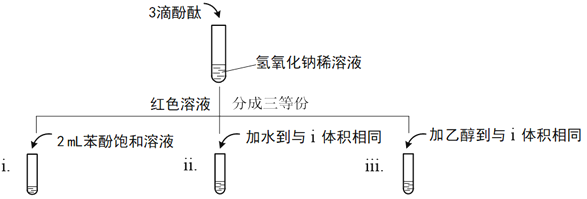
①写出苯酚与氢氧化钠反应的化学方程式______。
②证明苯酚显酸性的实验现象是______。
③苯不显酸性、乙醇不显酸性,苯酚中的羟基具有酸性是因为______。
(3)设计实验并结合实验现象证明苯酚中羟基对苯环的影响______。(文字描述、画图等均可)