题目内容
下列叙述中正确的是( )
分析:A、金属的熔沸点均有高低之分;
B、极性键是成键原子不一样的共价键,结构完全对称的极性键构成的分子是非极性分子;
C、根据氢离子的电离程度判断酸性的强弱;
D、水分子间存在氢键,导致水的沸点较高.
B、极性键是成键原子不一样的共价键,结构完全对称的极性键构成的分子是非极性分子;
C、根据氢离子的电离程度判断酸性的强弱;
D、水分子间存在氢键,导致水的沸点较高.
解答:解:A、金属铝的熔点较高,但是金属钠的熔点就很低,故A错误;
B、H2O2、PCl5都含有极性键,结构不完全对称,属于极性分子,故B错误;
C、在物质中H-X之间的化学键键长增大,氢离子的电离程度逐渐增大,酸性增强,故C正确;
D、水分子间存在氢键,导致水的沸点较高,而水的稳定性是化学键的表现,故D错误.
故选C.
B、H2O2、PCl5都含有极性键,结构不完全对称,属于极性分子,故B错误;
C、在物质中H-X之间的化学键键长增大,氢离子的电离程度逐渐增大,酸性增强,故C正确;
D、水分子间存在氢键,导致水的沸点较高,而水的稳定性是化学键的表现,故D错误.
故选C.
点评:本题考查学生有关化学键以及分子间作用力氢键的知识,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
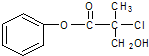 有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )| A、有机物A可以在一定条件下与HBr发生反应 | B、1mol A最多能与4mol H2发生加成反应 | C、有机物A与浓硫酸混合加热,可以发生消去反应 | D、1mol A与足量的NaOH溶液反应,最多可以消耗3mol NaOH |


