题目内容
8.现有常温下水电离出的c(H+)均为1×10-11mol/L的4种溶液:①HCl溶液;②CH3COOH溶液;③NaOH溶液;④氨水.有关上述溶液的比较中,正确的是( )| A. | 向等体积溶液中分别加水稀释100倍后,溶液的pH:③>④>②>① | |
| B. | 等体积的①、②、③溶液分别与足量铝粉反应,生成H2的量①最小 | |
| C. | ②、③溶液等体积混合后,溶液显碱性 | |
| D. | ①、④溶液混合若pH=7,则消耗溶液的体积:④>① |
分析 常温下水电离出的c(H+)均为1×10-11mol/L,则溶质抑制了水的电离,该溶液为酸溶液或碱溶液,①③为强电解质,都是一元强酸或强碱,则二者浓度为0.001mol/L;②④为弱电解质,在溶液中只能部分电离,则其浓度大于0.001mol/L,
A.加水稀释后,碱溶液的pH一定大于酸溶液的,弱碱溶液的pH大于强碱、弱酸溶液的pH小于强酸;
B.铝足量,酸、碱溶液完全反应,根据浓度大小及氢离子、氢氧根离子与生成氢气的量的关系判断;
C.根据分析可知,醋酸浓度大于氢氧化钠,混合液中醋酸过量,溶液显示酸性;
D.氨水的浓度大于氯化氢溶液,若要使混合液为中性,则氯化氢溶液体积应该大于氨水.
解答 解:常温下水电离出的c(H+)均为1×10-11mol/L,则溶质抑制了水的电离,该溶液为酸溶液或碱溶液,①③为一元强酸或强碱,则二者浓度为0.001mol/L;②④为弱电解质,在溶液中只能部分电离,则其浓度大于0.001mol/L,
A.由于加水稀释100倍后,弱电解质电离程度增大,溶液中弱酸电离出的氢离子、弱碱的电离出的氢氧根离子的物质的量增大,所以强电解质溶液的pH变化为2,弱电解质溶液的pH变化小于2,故稀释后溶液的pH大小为:④>③>①>②,故A错误;
B.铝足量时,2mol氯化氢生成1mol氢气,2mol氢氧化钠生成3mol氢气,①③的浓度相等,所以③生成的氢气大于①;②的浓度大于①,所以生成的氢气大于①,即:等体积、铝足量时①生成的氢气最少,故B正确;
C.②、③溶液等体积混合后,由于醋酸浓度大于氢氧化钠溶液,所以混合液中醋酸过量,反应后的溶液显示酸性,故C错误;
D.①、④溶液混合若pH=7,由于氨水的浓度大于氯化氢溶液,则消耗氯化氢溶液的体积应该加大,即:消耗溶液的体积:④<①,故D错误;
故选B.
点评 本题考查了弱电解质的电离及其影响,题目难度中等,明确酸碱溶液对水的电离的影响为解答关键,注意明确弱电解质在溶液中部分电离,试题侧重考查学生的分析、理解能力.


(注:碳酸钠与碳酸氢钠的溶解过程的热效应忽略不计)
| A. | △H1<△H2 | |
| B. | 若反应HCO3-+H+=CO2↑+H2O的熵增效应大于吸热效应,则其在常温常下能自发进行 | |
| C. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(△H1+△H2-△H3) kJ/mol | |
| D. | 相同条件下,结合H+的能力:CO32->HCO3- |
| A. | PM2.5表示每立方米空气中直径小于或等于2.5μm的颗粒物的含量,PM2.5值越高,大气污染越严重,因此由PM2.5引起的雾霾一定属于胶体 | |
| B. | 分光光度计可用于分析溶液颜色与反应物(或生成物)浓度的关系,从而确定化学反应速率 | |
| C. | 对“地沟油”加工处理可以达到变废为宝的目的,比如对“地沟油”进行分馏可以制得汽油、煤油 | |
| D. | 次氯酸和臭氧都是强氧化剂,都能杀死水中的细菌.自来水常用氯气来杀菌消毒,是因为氯气杀菌消毒效果要比臭氧好,且不会残留有毒、有害物质 |
(1)O2-的离子结构示意图为
 ,CS2的晶体类型为分子 晶体;
,CS2的晶体类型为分子 晶体;(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例ClO2、O3、Cl2(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是甲醇分子之间能形成氢键而乙烷不能;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是Fe(FeCl3)能催化苯与氯气的反应.
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于1:2
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物.已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体.该气体被溴水全部吸收后,溴水增重2.8g.请写出该水解反应方程式MgC+2H2O=Mg(OH)2+C2H4.
 下列①②对应的试剂(或条件)不能完成实验目的是( )
下列①②对应的试剂(或条件)不能完成实验目的是( )| 实验目的 | 试剂(或条件) | |
| A | 温度对Na2S2O3与H2SO4反应速率的影响 | ①热水浴②冷水浴 |
| B | 用Na块检验乙醇分子存在不同与烃分子里的氢原子 | ①乙醇②煤油 |
| C | 用酸化的AgNO3溶液检验来自水中Cl-能否蒸馏除去 | ①自来水②蒸馏水 |
| D | 用溴水检验苯的同系物种取代基对苯活性有影响 | ①苯②甲苯 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 葡萄糖、油脂、蛋白质在一定条件下均可以发生水解反应 | |
| B. | 赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石 | |
| C. | 石油分馏、煤的气化、海水制食盐、纤维素加工等过程都包含化学变化 | |
| D. | “地沟油”经过加工处理后可以用来制肥皂 |
 如图是检验气体性质的实验装置.向装置中缓慢通入气体X,若关闭活塞K,品红溶液无变化、澄清石灰水变浑浊;若打开活塞K,品红溶液褪色.据此判断,气体X和液体Y可能是( )
如图是检验气体性质的实验装置.向装置中缓慢通入气体X,若关闭活塞K,品红溶液无变化、澄清石灰水变浑浊;若打开活塞K,品红溶液褪色.据此判断,气体X和液体Y可能是( )| 选项 物质 | A | B | C | D |
| X | H2S | SO2 | CO2 | Cl2 |
| Y | 浓硫酸 | NaHCO3饱和溶液 | Na2SO3 溶液 | NaHSO3 溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 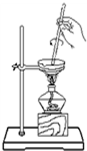 从碘水中分离出碘 | B. | 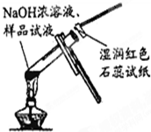 检验试液中NH4+的存在 | ||
| C. |  干燥SO2气体 | D. | 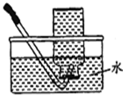 收集HCl气体 |
