��Ŀ����
����Ŀ������ʵ���г������������������Һ��Ũ���к�Ӱ�죺
��1����Ũ�����ܽ��δ��ȴ�����¼�ת��������ƿ�н��ж��ݣ����ƫ�ߡ�����ƫ�͡�����Ӱ�족����
�ڶ���ʱ���ӿ̶��ߣ����ƫ�ߡ�����ƫ�͡�����Ӱ�족����
����ȡ��Ũ���ᵹ���ձ��ܽ����ˮϴ����Ͳ2��3�Σ���ϴ��Һ�����ձ��У� �� ���ƫ�ߡ�����ƫ�͡�����Ӱ�족����
��2��7.8gþ���Ͻ���������ϡ���ᷴӦ���������������Ϊ8.96L����״��������˷�Ӧ��ת�Ƶ��ӵ���ĿΪ �� þ�����ֱ�������������֮��Ϊ ��
���𰸡�
��1��ƫ�ߣ�ƫ�ͣ�ƫ��
��2��0.8NA��2��3
���������⣺��1����Ũ�����ܽ��δ��ȴ�����¼�ת��������ƿ�н��ж��ݣ���ȴ����Һ���ƫС����ҺŨ��ƫ�ߣ����Դ��ǣ�ƫ�ߣ��ڶ���ʱ���ӿ̶��ߣ�������Һ���ƫ����ҺŨ��ƫ�ͣ�
���Դ��ǣ�ƫ�ͣ�����ȡ��Ũ���ᵹ���ձ��ܽ����ˮϴ����Ͳ2��3�Σ���ϴ��Һ�����ձ��У�������ȡ��Ũ�������ƫ�����ʵ����ʵ���ƫ����ҺŨ��ƫ�ߣ�
���Դ��ǣ�ƫ�ߣ���2����7.8gþ���Ͻ���Mg�����ʵ���Ϊxmol��Al�����ʵ���Ϊymol����24x+27y=7.8��
�������������ʵ���Ϊ ![]() =0.4mol�����ݵ���ת���غ��У�2x+3y=0.4��2��
=0.4mol�����ݵ���ת���غ��У�2x+3y=0.4��2��
�������̣���ã�x=0.1��y=0.2��
��ת�Ƶ�����Ϊn��
2H+��H2����2e��
1 2
0.4mol n
���n=0.8mol��
����ת�Ƶ�����Ϊ0.8NA��
����þ���������ᷴӦ���������ϵ�ã�
Mg������H2�� Al������1.5H2��
1 2 1 1.5
0.1mol 0.2mol 0.2mol 0.3mol
����þ���������ᷴӦ�������������֮�ȵ������ʵ���֮�ȵ��ڣ�0.2��0.3=2��3��
���Դ��ǣ�0.8NA��2��3��

 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д�����Ŀ��ij��ѧС���Ա�����Ϊԭ�ϣ���ȡ�������������֪�й����ʵķе������
���� | �״� | ������ | ��������� |
�е�/�� | 64.7 | 249 | 199.6 |
��1���ϳɱ���������ֲ�Ʒ ��i��������λͬѧ�ֱ��������ͼ��ʾ������ʵ���Һϳɱ����������װ�ã��г������ͼ�������������ȥ���������л���ķе㣬��ò�������ס����ҡ���װ�ã������� �� 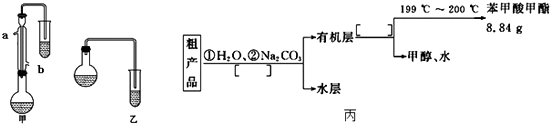
��ii��ʵ����Ũ���������������ˮӦ�����a����b������ͬ���ڽ����ڳ���
��iii����Ӧ��CH3OHӦ������������������װ���е���ĩ�˾�û�����뵽�Թ�Һ�����µ�ԭ�� ��
��2���ֲ�Ʒ�ľ��� ����������ֲ�Ʒ���������������״����������ˮ�ȣ���������������ͼ���о��ƣ���������ͼ���з�����������������������ƣ�
