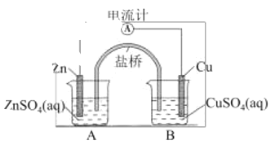
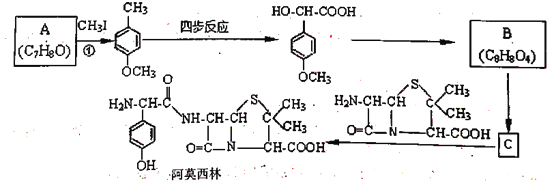
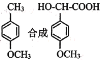
题目内容
【题目】由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能说明这个结论的是![]()
A.已经制得了IBr、ICl等卤素互化物
B.已经制得了![]() 等碘的氧化物
等碘的氧化物
C.已经制得了![]() 、
、![]() 等含
等含![]() 离子的离子化合物
离子的离子化合物
D.碘单质![]() 在通常情况下为具有金属光泽的紫黑色固体
在通常情况下为具有金属光泽的紫黑色固体
【答案】C
【解析】
碘是卤素中原子半径较大的元素,可能呈现金属性,说明它可以失电子形成阳离子,类似金属失电子形成金属阳离子。
A.IBr、ICl是共价化合物,这些化合物中都不存在单独的![]() ,所以不能根据这些事实证明碘元素呈现金属性,故A错误;
,所以不能根据这些事实证明碘元素呈现金属性,故A错误;
B.![]() 等碘的氧化物是共价化合物,不存在单独的
等碘的氧化物是共价化合物,不存在单独的![]() ,所以不能根据这些事实证明碘元素呈现金属性,故B错误;
,所以不能根据这些事实证明碘元素呈现金属性,故B错误;
C.![]() 、
、![]() 等化合物中存在
等化合物中存在![]() ,体现了金属性,故C正确;
,体现了金属性,故C正确;
D.碘![]() 在通常情况下为具有金属光泽的紫黑色固体,此为物理性质,与金属性无关,故D错误;
在通常情况下为具有金属光泽的紫黑色固体,此为物理性质,与金属性无关,故D错误;
答案选C。

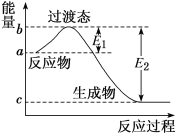
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=_________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
(4)为加快反应速率,可以采取的措施是_______
a.降低温度
b.增大压强
c.恒容时充入He气
d.恒压时充入He气
e.及时分离NH3