题目内容
16.已知直链烷烃A比B多一个碳原子,则下列说法正确的是( )| A. | A沸点比B低 | |
| B. | 若A、B均为气体,则A比B易液化 | |
| C. | A相对密度比B小 | |
| D. | 已知A在常温下为液态,则B不可能为气态 |
分析 直链烷烃A比B多一个碳原子,烷烃中碳原子个数越多其熔沸点越高、密度越大,烷烃的同分异构体中支链越多其熔沸点越低,碳原子小于或等于4的烷烃常温下呈气态,据此分析解答.
解答 解:A.直链烷烃A比B多一个碳原子,烷烃中碳原子个数越多其熔沸点越高、密度越大,A的碳原子个数大于B,所以A的熔沸点高于B,故A错误;
B.A的熔沸点高于B,A比B易液化,故B正确;
C.直链烷烃A比B多一个碳原子,烷烃中碳原子个数越多其熔沸点越高、密度越大,A的碳原子个数大于B,所以A的密度大于B,故C错误;
D.如果A在常温下为液态,则B可能为气态,如A是戊烷B是丁烷,故D错误.
故选B.
点评 本题考查烷烃熔沸点、密度大小比较,明确烷烃中碳原子个数与物质熔沸点高低关系即可解答,属于基础题,题目难度不大.

练习册系列答案
相关题目
6.下列有机物的化学式与名称对应不正确的是( )
| A. |  石炭酸 石炭酸 | B. |  TNT TNT | ||
| C. | CH3COOH 乙酸 | D. | CH2BrCH2Br 1,2-二溴乙烷 |
4.起固定氮作用的化学反应是( )
| A. | NO与空气中的氧气反应生成NO2 | B. | 硝酸工厂用NH3氧化制NO | ||
| C. | N2与H2在一定条件下反应生成NH3 | D. | 由NH3制碳酸氢铵和硫酸铵 |
8.下列属于分子晶体的一组物质是( )
| A. | CaO、NO、CO | B. | CCl4、H2O2、He | C. | CO2、SO2、NaCl | D. | CH4、O2、Na2O |
5.实室用空气和下列药品、仪器装置制取少量氮化镁.
(1)如果所制气体从左向右流向时,各个装置中导管连接的正确顺序是H接F、E接D、C接M、N接A.
(2)实验开始时,应先在(填字母)G处接通自来水管,然后再依次点燃装有Cu粉装置酒精灯和装有Mg粉装置的酒精灯.
(3)浓H2SO4的作用除去空气中的水,饱和Na0H溶液发生反应的离子方程式:CO2+2OH-=H2O+CO32-.
(4)装置5中发生反应的化学方程式2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;
(5)装置1中发生反应的化学方程式:3Mg+N2$\frac{\underline{\;\;△\;\;}}{\;}$Mg3N2.
(6)若空气中的氧未除尽,则制取的Mg3N2中一定含有氧化镁.
(7)氮化镁能与水反应生成Mg(OH)2和NH3,若取含有MgO的Mg3N2的混合物2.5g,恰好与370毫升0.5摩/升的盐酸完全反应,该混合物中MgO的质量分数为20%.
| 序号 | 1 | 2 | 3 | 4 | 5 |
| 仪器及装置 |  |  |  |  |  |
(2)实验开始时,应先在(填字母)G处接通自来水管,然后再依次点燃装有Cu粉装置酒精灯和装有Mg粉装置的酒精灯.
(3)浓H2SO4的作用除去空气中的水,饱和Na0H溶液发生反应的离子方程式:CO2+2OH-=H2O+CO32-.
(4)装置5中发生反应的化学方程式2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;
(5)装置1中发生反应的化学方程式:3Mg+N2$\frac{\underline{\;\;△\;\;}}{\;}$Mg3N2.
(6)若空气中的氧未除尽,则制取的Mg3N2中一定含有氧化镁.
(7)氮化镁能与水反应生成Mg(OH)2和NH3,若取含有MgO的Mg3N2的混合物2.5g,恰好与370毫升0.5摩/升的盐酸完全反应,该混合物中MgO的质量分数为20%.
6.如图各坐标中Z为第三周期元素的核电荷数,Y表示相应元素的有关性质,其中曲线描述与元素有关性质相符的选项是( )
| A. |  Y表示原子半径 | B. |  Y表示元素的电负性 | ||
| C. | 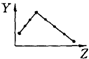 Y表示元素的最高正价 | D. |  Y表示元素的第一电离能 |
 ;若取一定量的B完全燃烧后,生成3mol CO2和1.5mol H2O,则有39g烃B参加了反应,燃烧时消耗氧气3.75mol.
;若取一定量的B完全燃烧后,生成3mol CO2和1.5mol H2O,则有39g烃B参加了反应,燃烧时消耗氧气3.75mol.