��Ŀ����
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣���Ա��еĢ���Ԫ�أ���Ԫ�ط��Ż�ѧʽ�ش�������⣺

��1������ЩԪ���У���ѧ��������õ�ԭ�ӵ�ԭ�ӽṹʾ��ͼΪ______________��
��2����ЩԪ���е�����������Ӧ��ˮ�����У�������ǿ����________��������ǿ����_________��
��3���ݵĵ���������������Һ��Ӧ�Ļ�ѧ����ʽΪ_______________________��
�ݵ���������������������Һ��Ӧ�����ӷ���ʽΪ_______________________��
��4�����ߵ���ͨ��������ɵĻ������У�������Ӧ�����ӷ���Ϊ_____________��
��5���ٵĵ��ʳ�������ҵ�Ϻϳ�ij�ּ������壬д���ü������屻�����������ķ�Ӧ��ѧ����ʽ________________________��
��6��д���������ʵĵ���ʽ��
���γɵĵ���______��
������γɵ�����________��
�õ���ʽ��ʾ�������������ʵ��γɹ���___________��
���𰸡� ![]() HClO4 KOH 2Al+2NaOH+2H2O=2NaAlO2+3H2�� Al(OH)3+OH-=AlO2-+2H2O Cl2+2Br-=2Cl-+Br2 4NH3+5O2
HClO4 KOH 2Al+2NaOH+2H2O=2NaAlO2+3H2�� Al(OH)3+OH-=AlO2-+2H2O Cl2+2Br-=2Cl-+Br2 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O ![]()
![]()
![]()
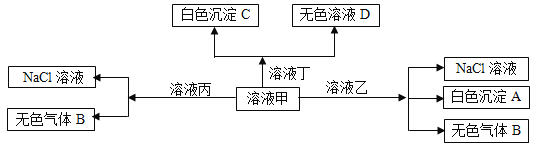
�����������������������Ҫ����Ԫ�������ɡ���Ԫ�����ڱ����Ե�֪�٢ڢۢܢݢޢߢ���ֱ��ǵ��������ơ�þ�������衢�ȡ�벡��ء��塣
��1������ЩԪ���У���ѧ�����������벣���ԭ�ӽṹʾ��ͼΪ![]() ��
��
��2����ЩԪ���е�����������Ӧ��ˮ�����У�������ǿ����HClO4��������ǿ����KOH��
��3���ݵĵ���������������Һ��Ӧ�Ļ�ѧ����ʽΪ2Al+2NaOH+2H2O=2NaAlO2+3H2����
�ݵ���������������������Һ��Ӧ�����ӷ���ʽΪAl(OH)3+OH-=AlO2-+2H2O��
��4�����ߵ���ͨ��������ɵĻ������У�������Ӧ�����ӷ���ΪCl2+2Br-=2Cl-+Br2��
��5���ٵĵ��ʳ�������ҵ�Ϻϳ�ij�ּ������壬�ü������屻�����������ķ�Ӧ��ѧ����ʽΪ4NH3+5O2![]() 4NO+6H2O��
4NO+6H2O��
��6���������ʵĵ���ʽ��
���γɵĵ��ʵ������������γ��������ۼ���![]() ��
��
������γ����ӻ������廯�ƣ�![]() ��
��
�õ���ʽ��ʾ�������ɵ����ӻ������Ȼ�þ���γɹ��̣�![]() ��
��

 ����С��ʿ���������ϵ�д�
����С��ʿ���������ϵ�д�����Ŀ�����ǻ�ѧʵ���Ҽ����������е���Ҫ���ʣ�Ӧ�ù㷺��
��1����֪25��ʱ��N2(g) �� O2(g) ![]() 2NO(g) ��H = +183 kJ/mol
2NO(g) ��H = +183 kJ/mol
2H2(g) �� O2(g) === 2H2O(l) ��H = ��571.6 kJ/mol
4NH3(g) �� 5O2(g) === 4NO(g) ��6H2O(l) ��H = ��1164.4 kJ/mol
�� N2(g) �� 3H2(g) ![]() 2NH3(g) ��H = ___________ kJ/mol
2NH3(g) ��H = ___________ kJ/mol
��2���ں��º�����ϵ�н��еĺϳɰ���Ӧ��������˵���÷�Ӧ�Ѵﵽƽ��״̬����___________
A��������N2��H2��NH3��Ũ��֮��Ϊ1�U3�U2
B��3v��N2������v��H2����
C��������ѹǿ���ֲ���
D������1mol N2��ͬʱ����2molNH3
��3���ں��º����ܱ������н��кϳɰ���Ӧ����ʼͶ��ʱ������Ũ�����±���
N2 | H2 | NH3 | |
Ͷ�Ϣ� | 1.0 mol/L | 3.0 mol /L | 0 |
Ͷ�Ϣ� | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
�� ��Ͷ�Ϣ���з�Ӧ����ôﵽ��ѧƽ��״̬ʱH2��ת����Ϊ40%������¶��ºϳɰ���Ӧ��ƽ�ⳣ��K=_________________��ֻ��������ݣ����ü�������
�� ��Ͷ�Ϣ���з�Ӧ����ʼʱ��Ӧ���еķ���Ϊ________�����������
��4���绯ѧ���������������ڼ�����NH3�ĺ������乤��ԭ��ʾ��ͼ���£�д���缫a�ĵ缫��Ӧʽ��________________________