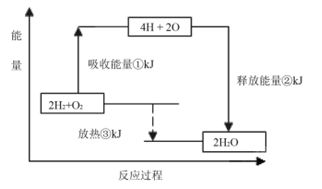
题目内容
2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。

已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中C表示 ;该反应通常用V2O5作催化剂,加V2O5会使图中B点降低,理由是 ;
(2)图中△H= kJ·mol-1;
(3)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1;
(4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H= 。
 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中C表示 ;该反应通常用V2O5作催化剂,加V2O5会使图中B点降低,理由是 ;
(2)图中△H= kJ·mol-1;
(3)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1;
(4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H= 。
(1)生成物总能量;催化剂能降低反应所需要的能量,提高活化分子百分数
(2)-198 (3)0.025 (4)-1185kJ/mol
(2)-198 (3)0.025 (4)-1185kJ/mol
试题分析:(1)图中A表示反应物总能量,C表示生成物总能量。E为活化能,使用催化剂,活化能降低,活化分子数增加,活化分子百分数增加。
(2)1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1,所以2SO2(g)+O2(g)
 2SO3(g) ΔH=-198kJ·mol-1。
2SO3(g) ΔH=-198kJ·mol-1。(3)化学反应速率比等于化学计量数比。
(4)由硫的燃烧热可写出热化学方程式:S(g)+O2(g)=SO2(g) ΔH=-296kJ·mol-1,由2SO2(g)+O2(g)
 2SO3(g) ΔH=-198kJ·mol-1利用盖斯定律得S(g)+O2(g)=SO3(g) ΔH=-395kJ·mol-1,所以生成3 molSO3(g)的△H=-1185kJ/mol。
2SO3(g) ΔH=-198kJ·mol-1利用盖斯定律得S(g)+O2(g)=SO3(g) ΔH=-395kJ·mol-1,所以生成3 molSO3(g)的△H=-1185kJ/mol。点评:热化学方程中化学计量数表示物质的量。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

 ,
, 

 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右: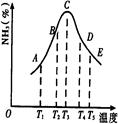
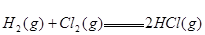 ;
;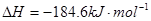 ,则反应
,则反应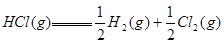 的△H为( )
的△H为( )