题目内容
A、B、C、D为短周期中相邻两周期中的元素,其原子序数A>B>C>D.D和A形成简单离子后,它们电子层相差两层.已知A处于第n族,D处于第m族.且A单质在化学反应中易得电子.B的气态氢化物的化学式为H2B,在其最高价氧化物中B的质量分数为40%,B原子核内质子数和中子数相等.C和A可形成CA3型化合物,C和A、B同在一周期,B与A左右相邻.试回答:
(1)若n-m=6,则A、D形成的化合物的化学式是________.
(2)D的原子序数为(用含m的代数式表示)________.
(3)C的离子结构示意图为________.
解析:
|
答案:(1)LiCl (2)2+m (3)Al3+ 解析:可用定量法确定B元素;由H2B可知B的最高价氧化物为BO3.设B的相对原子质量为x,则: 因为B原子核内质子数和中子数相等,所以B元素的质子数为16,B为硫元素. 根据A单质在反应中易得电子,可知A为非金属元素.由原子序数A>B,A为短周期元素可知A为氯元素. 根据CA3,A是-1价,则C是+3价,可知C为ⅢA族元素.由于C与A、B在同一周期,所以C为铝元素. 根据D和A形成简单离子后,它们的电子层数相差两层,可知D的离子只有一个电子层.由A、B、C、D为相邻两周期的元素,A、B、C为第3周期元素,可知D为第2周期的金属元素. (1)当n-m=6时,Cl元素位于ⅦA族,n=7,m=1,D元素位于ⅠA族.可见D为锂元素. (2)D位于第2周期,第m族.周期序数=电子层数,主族族序数=最外层电子数,且第一层只能容纳2个电子.D原子核外电子数为2+m,即D的原子序数为2+m. (3)Al3+ |

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案【化学一选修3:物质结构与性质】(15分)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
形
(2)某同学根据上述信息,所画的B电子排布图如图

违背了 原理。
(3)F位于 族 区,其基态原子有 种运动状态。
(4)CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 .检验E元素的方法是
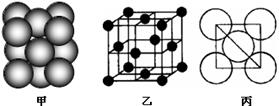
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 .
【化学一选修3:物质结构与性质】(15分)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
|
A元素原子的核外p电子总数比s电子总数少1 |
|
B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
|
C原子核外所有p轨道全满或半满 |
|
D元素的主族序数与周期数的差为4 |
|
E是前四周期中电负性最小的元素 |
|
F在周期表的第七列 |
(1)A基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈
形
(2)某同学根据上述信息,所画的B电子排布图如图
违背了 原理。
(3)F位于 族 区,其基态原子有 种运动状态。
(4)CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 .检验E元素的方法是
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 .

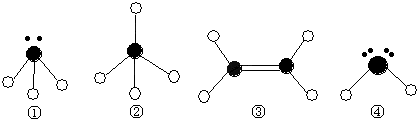

 ,违背了 原理。
,违背了 原理。