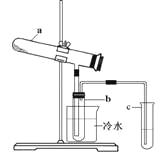
题目内容
【题目】IBr、ICl等称之为卤素互化物,![]() 、
、![]() 、
、![]() 等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
![]() 氯化碘
氯化碘![]() 能与水发生反应:
能与水发生反应:![]() ,该反应_______
,该反应_______![]() 填“是”或“不是”
填“是”或“不是”![]() 氧化还原反应。
氧化还原反应。
![]() 溴化碘
溴化碘![]() 具有强氧化性,能与
具有强氧化性,能与![]() 溶液发生反应,发生反应的离子方程式为___。
溶液发生反应,发生反应的离子方程式为___。
![]() 已知某些离子的还原性强弱顺序为
已知某些离子的还原性强弱顺序为![]() 。现将几滴KSCN溶液滴入到含少量
。现将几滴KSCN溶液滴入到含少量![]() 的溶液中,溶液立即变红,向其中逐滴滴入酸性
的溶液中,溶液立即变红,向其中逐滴滴入酸性![]() 溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象_______________。
溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象_______________。
![]() 下列物质中,也可以使该溶液红色褪去的是 _________。
下列物质中,也可以使该溶液红色褪去的是 _________。
A.新制氯水 ![]() 碘水
碘水 ![]()
![]() 盐酸
盐酸
![]() 为剧毒物质,处理含有KCN的废水常用的方法是:在碱性条件下用NaClO溶液将
为剧毒物质,处理含有KCN的废水常用的方法是:在碱性条件下用NaClO溶液将![]() 氧化为
氧化为![]() 和一种单质气体,该反应的离子方程式为_______________。
和一种单质气体,该反应的离子方程式为_______________。
【答案】![]()
![]() 酸性高锰酸钾将
酸性高锰酸钾将![]() 氧化,减小了
氧化,减小了![]() 的浓度,使
的浓度,使![]() ,平衡不断向左移动,最终
,平衡不断向左移动,最终![]() 完全反应,红色消失
完全反应,红色消失 ![]()
![]()
【解析】
(1)反应中各元素化合价不变,不是氧化还原反应;
![]() 溴化碘
溴化碘![]() 具有强氧化性,能与
具有强氧化性,能与![]() 溶液反应,反应中IBr被还原,亚硫酸钠被氧化;
溶液反应,反应中IBr被还原,亚硫酸钠被氧化;
![]() 根据平衡移动原理分析;
根据平衡移动原理分析;
![]() 能与
能与![]() 或
或![]() 反应的离子可使溶液褪色,其中氯水与
反应的离子可使溶液褪色,其中氯水与![]() 反应,二氧化硫与铁离子反应;
反应,二氧化硫与铁离子反应;
![]() 碱性条件下
碱性条件下![]() 与NaClO反应生成
与NaClO反应生成![]() 、
、![]() 和
和![]() 。
。
![]() 为复分解反应,不是氧化还原反应,
为复分解反应,不是氧化还原反应,
故答案为:不是;
![]() 溴化碘
溴化碘![]() 具有强氧化性,能与
具有强氧化性,能与![]() 溶液反应,反应中IBr被还原,亚硫酸钠被氧化,反应的离子方程式为
溶液反应,反应中IBr被还原,亚硫酸钠被氧化,反应的离子方程式为![]() ,
,
故答案为:![]() ;
;
![]() 溶液中存在
溶液中存在![]() ,高锰酸钾具有强氧化性,可氧化
,高锰酸钾具有强氧化性,可氧化![]() ,则酸性高锰酸钾将
,则酸性高锰酸钾将![]() 氧化,减小了
氧化,减小了![]() 的浓度,使
的浓度,使![]() ,平衡不断向左移动,最终
,平衡不断向左移动,最终![]() 完全反应,红色消失
完全反应,红色消失
故答案为:酸性高锰酸钾将![]() 氧化,减小了
氧化,减小了![]() 的浓度,使
的浓度,使![]() ,平衡不断向左移动,最终
,平衡不断向左移动,最终![]() 完全反应,红色消失;
完全反应,红色消失;
![]() 能与
能与![]() 或
或![]() 反应的离子可使溶液褪色,其中氯水与
反应的离子可使溶液褪色,其中氯水与![]() 反应,二氧化硫与铁离子反应,
反应,二氧化硫与铁离子反应,
故答案为:AC;
![]() 碱性条件下
碱性条件下![]() 与NaClO反应生成
与NaClO反应生成![]() 、
、![]() 和
和![]() ,反应的离子方程式为
,反应的离子方程式为![]() ,
,
故答案为:![]() 。
。

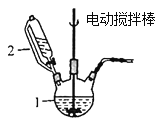
【题目】用O2将HCl转化为Cl2,可提高效益,减少污染,
(1)传统上该转化通过如图所示的催化剂循环实现,

其中,反应①为:2HCl(g) + CuO(s)![]() H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为___________(反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
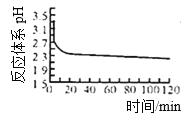
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的aHCl—T曲线如图,则总反应的△H___0(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是_______。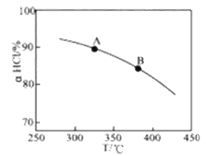
②在上述实验中若压缩体积使压强增大,画出相应aHCl—T曲线的示意图,并简要说明理由______________。
③下列措施中有利于提高aHCl的有___________。
A、增大n(HCl) B、增大n(O2)
C、使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率______(以mol·min-1为单位,写出计算过程)。
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学方程式______________。
【题目】关于下列各图的叙述错误的是![]()
化学方程式 | 平衡常数K |
|
|
|
|
|
|
|
|
A.已知1molCO燃烧放出的热为283kJ,![]() ;
;![]() 则
则 表示CO和
表示CO和![]() 生成
生成![]() 和
和![]() 的能量变化
的能量变化
B.常温下![]()
![]() HB溶液和
HB溶液和![]()
![]() 溶液等体积混合后溶液的
溶液等体积混合后溶液的![]() ,则混合溶液中离子浓度的大小顺序为:
,则混合溶液中离子浓度的大小顺序为:![]()
C.常温下,![]() 和
和![]() 反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时
反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时![]() 从
从![]() 到
到![]() 的转化率逐减小,且HX的还原性逐渐减弱
的转化率逐减小,且HX的还原性逐渐减弱
D.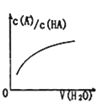 中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中, 的变化情况
的变化情况