题目内容
(1)下表是不同温度下SO2的平衡转化率.[原料气成分(体积分数);SO2 7%,O2 11%,N2 82%;压强;0.1MPa]
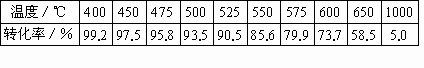
SO2接触氧化是一个放热反应.根据化学平衡理论判断,此反应在温度较低的条件下进行最为有利.但为什么实际生产中,选定400℃~500℃作为操作温度?
(2)压强对SO2平衡转化率的影响[原料气成分同第(1)题]
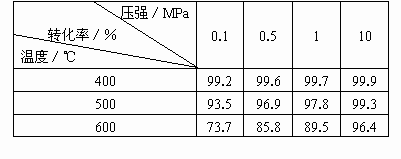
根据化学平衡理论,考虑综合经济效益,结合表中数据,分析回答为什么SO2接触氧化在常压下进行?
解析:
|
(1)温度较低时催化剂活性不高,反应速率低,从综合经济效益考虑,对生产不利.在400℃~500℃温度范围内,催化剂活性高,反应速率和SO2的平衡转化率(93.5%~99.2%)都比较理想. (2)分析表中数据说明,增大气体压强,能相应提高SO2的平衡转化率,但提高不多.常压下,SO2的转化率已经很高(97.8%~99.7%),考虑到加压必须增加设备,增大投资和能量消耗.从综合经济效益考虑不合算. |

[原料气成分(体积分数):SO2:7%,O2:11%,N2:82%;压强:0.1Mpa]
温度/℃ | 400 | 450 | 500 | 525 | 550 | 575 | 600 | 650 | 1 000 |
转化率/% | 99.2 | 97.5 | 95.8 | 93.5 | 90.5 | 85.6 | 79.9 | 73.7 | 58.5 |
SO2接触氧化是一个放热反应。根据化学平衡理论判断,此反应在温度较低的条件下最为有利。但为什么实际生产中,选定400—500 ℃作为操作温度?
(2)压强对SO2平衡转化率的影响的有关参数如下表[原料气成分同第(1)题]
压强/Mpa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
400 | 99.2 | 99.6 | 99.7 | 99.9 |
500 | 93.5 | 96.9 | 97.8 | 99.3 |
600 | 73.7 | 85.8 | 89.5 | 96.4 |
根据化学平衡理论,考虑综合经济效益,结合表中数据,分析回答为什么SO2接触氧化在常压下进行。
