题目内容
某固体物质是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2中的几种混合而成,取样品进行如下实验(部分产物略去):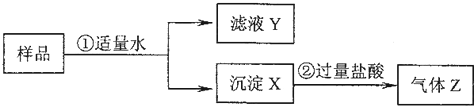
(1)Z的分子式是
(2)在实验②中观察到的现象是“沉淀部分溶解”.为进一步确定X的组成,向实验②后的溶液中滴加过量的氨水,有沉淀生成,生成沉淀反应的离子方程式为:
(3)取滤液Y,分析可知其中含有AlO2-;向其中滴入硫酸钠溶液,未观察到任何现象,由上述推断可见,实验①中能反应的物质之间的物质的量的比例关系为(用
| n(A) | m(B) |
分析:样品溶于水生成沉淀和滤液,沉淀X可能是CaCO3或K2SO4和Ba(NO3)2,混合生成的硫酸钡沉淀;或NaOH和AlCl3的混合物生成的沉淀Al(OH)3;又因为沉淀加入过量盐酸生成气体Z,说明溶于水形成的沉淀中含有CaCO3;据此分析.
解答:解:(1)样品溶于水生成沉淀和滤液,沉淀X可能是CaCO3或K2SO4和Ba(NO3)2,混合生成的硫酸钡沉淀;或NaOH和AlCl3的混合物生成的沉淀Al(OH)3;又因为沉淀加入过量盐酸生成气体Z,说明溶于水形成的沉淀含有CaCO3,气体Z为CO2;故答案为:CO2;
(2)沉淀部分溶解说明有硫酸钡,向实验②后的溶液中滴加过量的氨水,有沉淀生成,说明原来有AlCl3,即X中有Al(OH)3,则氨水与铝离子的反应方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;所以X中含有CaCO3、BaSO4、Al(OH)3;
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;CaCO3、BaSO4、Al(OH)3;
(3)取滤液Y,分析可知其中含有AlO2-;根据Al3++3OH-=Al(OH)3↓,Al3++4OH-=AlO2-+2H2O,所以
<
<
;向其中滴入硫酸钠溶液,未观察到任何现象,说明钡离子完全反应,即硫酸钾过了,所以
<1;
故答案为:
<
<
,
<1.
(2)沉淀部分溶解说明有硫酸钡,向实验②后的溶液中滴加过量的氨水,有沉淀生成,说明原来有AlCl3,即X中有Al(OH)3,则氨水与铝离子的反应方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;所以X中含有CaCO3、BaSO4、Al(OH)3;
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;CaCO3、BaSO4、Al(OH)3;
(3)取滤液Y,分析可知其中含有AlO2-;根据Al3++3OH-=Al(OH)3↓,Al3++4OH-=AlO2-+2H2O,所以
| 1 |
| 4 |
| n(AlCl3) |
| n(NaOH) |
| 1 |
| 3 |
| n(Ba(NO3)2) |
| n(K2SO4) |
故答案为:
| 1 |
| 4 |
| n(AlCl3) |
| n(NaOH) |
| 1 |
| 3 |
| n(Ba(NO3)2) |
| n(K2SO4) |
点评:本题考查了物质检验的方法和物质性质的应用,主要是根据反应现象和物质性质的分析判断,注意氯化铝在过量氢氧化钠溶液中生成的偏铝酸钠再加入过量盐酸又重新生成氯化铝溶液的判断,题目难度中等.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
某固体物质是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2中的几种均匀混合而成,取样品进行如图所示实验(部分产物略去):
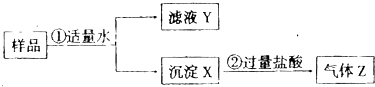
则下列判断正确的是( )

则下列判断正确的是( )
| A、沉淀X一定只含有CaCO3和BaSO4 | B、气体Z的成分无法确定 | C、取滤液Y,测得其pH>7,滤液Y中含有的含氧根离子可能是AlO2-、NO3- | D、向实验②后的溶液中滴加过量的烧碱,没有沉淀生成,说明肯定没有AlCl3 |


