题目内容
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.Y与Z同周期、与X相邻周期,Z原子最外层电子数既是X原子内层电子数的3倍,也是Y原子最外层电子数的3倍.下列说法不正确的是( )
| A、X的最高价氧化物的水化物有强氧化性 |
| B、Y的单质着火时,不能用二氧化碳灭火 |
| C、Z的两种氧化物在常温下容易相互转化 |
| D、X、Z的氧化物是共价化合物,Y的氧化物是离子化合物 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:短周期元素X、Y、Z的原子序数依次递增,Z原子最外层电子数是X原子内层电子数的3倍,则X只能有2个电子层,处于第二周期,X与Y、Z位于相邻周期,则Y、Z位于第三周期,故Z原子最外层电子数为6个电子,则Z为S;Z原子最外层电子数是Y原子最外层电子数的3倍,则Y原子最外层电子数为2,可推知Y为Mg;三原子的最外层电子数之和为13,则X的最外层电子数为13-2-6=5,即X为氮元素.
解答:
解:短周期元素X、Y、Z的原子序数依次递增,Z原子最外层电子数是X原子内层电子数的3倍,则X只能有2个电子层,处于第二周期,X与Y、Z位于相邻周期,则Y、Z位于第三周期,故Z原子最外层电子数为6个电子,则Z为S;Z原子最外层电子数是Y原子最外层电子数的3倍,则Y原子最外层电子数为2,可推知Y为Mg;三原子的最外层电子数之和为13,则X的最外层电子数为13-2-6=5,即X为氮元素,
A.X为N元素,最高价氧化物的水化物为硝酸,具有强氧化性,故A正确;
B.Mg与二氧化碳反应生成Mg与碳,故Mg失火不能用二氧化碳灭火,故B正确;
C.二氧化硫与三氧化硫在常温下不能相互转化,故C错误;
D.X、Z的氧化物是非金属性氧化物,是共价化合物,Y的氧化物是MgO,属于离子化合物,故D正确,
故选C.
A.X为N元素,最高价氧化物的水化物为硝酸,具有强氧化性,故A正确;
B.Mg与二氧化碳反应生成Mg与碳,故Mg失火不能用二氧化碳灭火,故B正确;
C.二氧化硫与三氧化硫在常温下不能相互转化,故C错误;
D.X、Z的氧化物是非金属性氧化物,是共价化合物,Y的氧化物是MgO,属于离子化合物,故D正确,
故选C.
点评:本题考查结构位置性质关系应用,判断X为第二周期元素为突破口,是解答本题的关键,注意熟悉元素化合物知识.

练习册系列答案
相关题目
常温条件下,将SO2气体通入一定量的NaOH溶液中,所得溶液呈中性,关于该溶液判断正确的是( )
| A、该溶液中的溶质为NaHSO3 |
| B、溶液中的离子浓度最大的是Na+ |
| C、溶液中C(Na+)=C(SO32-)+C(HSO3-) |
| D、该溶液的溶质为NaHSO3和NaOH |
下列原子或原子团中,不属于官能团的是( )
| A、氯原子 | B、羟基 | C、硝基 | D、苯环 |
下列关于NaHCO3和Na2CO3的说法正确的是( )
①NaHCO3比Na2CO3稳定,便于长期保存; ②NaHCO3与酸的反应比Na2CO3快;
③鉴别NaHCO3与Na2CO3可以用Ca(OH)2 ④产生等质量的CO2,NaHCO3耗酸少.
①NaHCO3比Na2CO3稳定,便于长期保存; ②NaHCO3与酸的反应比Na2CO3快;
③鉴别NaHCO3与Na2CO3可以用Ca(OH)2 ④产生等质量的CO2,NaHCO3耗酸少.
| A、①③④ | B、①②③④ |
| C、①③ | D、②④ |
某电化学装置如图,下列说法正确的是( )


| A、若X是盐桥,则电子由B电极经外电路流向A电极 |
| B、若X是铜条,则A电极的电极反应式是:Zn2++2e-═Zn |
| C、若X是石墨条,则乙池溶液的pH会减小 |
| D、若X是锌条,则A电极的质量会减小 |
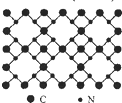 根据量子力学计算,氮化碳结构有五种,其中一种氮化碳硬度超过金刚石晶体,成为首届一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示.下列有关氮化碳的说法正确的是( )
根据量子力学计算,氮化碳结构有五种,其中一种氮化碳硬度超过金刚石晶体,成为首届一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示.下列有关氮化碳的说法正确的是( )| A、氮化碳属于分子晶体 |
| B、氮化碳的分了式为C3N4 |
| C、该晶体中的碳、氮原子核外都满足8电子稳定结构 |
| D、每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连 |
一定量的铜与100mL一定浓度的硝酸恰好完全反应生成硝酸铜和NO、NO2、N2O4的混合气体,将该混合气体收集在集气瓶中,把集气瓶倒立在水中,通入4.48L的氧气(在标准状况下)可以使集气瓶充满溶液.则下列说法一定正确的是( )
| A、铜的质量为12.8g |
| B、硝酸的物质的量浓度为12mol?L-1 |
| C、体现酸性的硝酸为0.8mol |
| D、被还原的硝酸为0.4mol |



 常温下,向100mL 0.01mol?L-1HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下,向100mL 0.01mol?L-1HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题: