题目内容
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)![]() 2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:
2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:
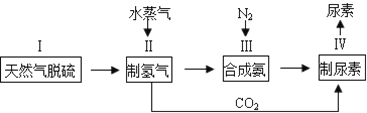
(1)步骤II中制氢气原理如下:
CH4(g)+H2O(g)![]() CO(g)+3H2(g) CO(g)+H2O(g)
CO(g)+3H2(g) CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
恒容容器中,对于以上反应,能加快反应速率的是_____________。
a. 升高温度 b. 充入He c. 加入催化剂 d. 降低压强
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______________。
(3)CO2和H2在高温、高压、催化剂条件下可合成CH3CH2OH,反应的化学方程式_________________________________。以CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:_________________________。
(4)已知尿素的结构简式为![]() ,请写出尿素的同分异构体中含有离子键的化学式_________。
,请写出尿素的同分异构体中含有离子键的化学式_________。
(5)已知CO2+ 2NH3![]() CO(NH2)2+ H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成__________吨尿素。
CO(NH2)2+ H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成__________吨尿素。
【答案】ac 2NH4HS+O2 2NH3·H2O+2S↓ 2CO2+6H2
2NH3·H2O+2S↓ 2CO2+6H2 CH3CH2OH+3H2O CH3CH2OH-12e-+16OH-= 2CO32-+11 H2O NH4OCN 300
CH3CH2OH+3H2O CH3CH2OH-12e-+16OH-= 2CO32-+11 H2O NH4OCN 300
【解析】
(1)改变外界条件可以使化学反应速率增大,如升高温度、增大压强、增大物质的浓度、使用催化剂等都可以使反应速率增大,故选ac。故答案为:ac;
(2)向NH4HS溶液中通入空气即与空气中的氧气反应,被氧气氧化为单质硫,吸收液再生即又可以得到氨水,反应物和产物都有,再根据氧化还原反应中得失电子守恒即可得到反应的化学方程式为:2NH4HS+O2![]() 2NH3·H2O+2S↓;故答案为:2NH4HS+O2
2NH3·H2O+2S↓;故答案为:2NH4HS+O2![]() 2NH3·H2O+2S↓;
2NH3·H2O+2S↓;
(3)CO2和H2在高温、高压、催化剂条件下可合成CH3CH2OH,反应的化学方程式:2CO2+6H2 CH3CH2OH+3H2O ;
CH3CH2OH+3H2O ;
在CH3CH2OH、空气、氢氧化钾溶液的燃料电池中,CH3CH2OH被氧气氧化失去电子在负极上发生反应,但是由于电解质溶液是碱性的,所以在电极上得到的产物为CO32-。负极上的反应为:CH3CH2OH-12e-+16OH-= 2CO32-+11 H2O;
故答案为:2CO2+6H2 CH3CH2OH+3H2O ;CH3CH2OH-12e-+16OH-= 2CO32-+11 H2O;
CH3CH2OH+3H2O ;CH3CH2OH-12e-+16OH-= 2CO32-+11 H2O;
(4) 尿素中含有N元素,N元素形成的离子有NH4+或NO3—,在本物质中含有H原子数较多,O原子数较少,故只能形成铵盐,尿素的同分异构体中含有离子键的化学式:NH4OCN;故答案为:NH4OCN;
(5)根据原子守恒法得到:
 ,则m=
,则m=![]() =300t。
=300t。
故答案为:300。