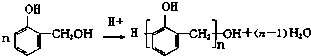��Ŀ����
����Ŀ������ԭ������С��20��A,B,C,D,E,F 6��Ԫ�أ����ǵ�ԭ����������������֪BԪ���ǵؿ��к�������Ԫ�أ�A��C�ļ۵�������ͬ��B��D�ļ۵�����Ҳ��ͬ����A��C��Ԫ��ԭ�Ӻ��������֮����B,D��Ԫ��ԭ�Ӻ���������֮�͵� ![]() ��C,D,E����Ԫ�صĻ�̬ԭ�Ӿ�����ͬ�ĵ��Ӳ�������Eԭ�ӵ�p����ϵ�������Dԭ�ӵ�p����϶�һ�����ӣ�6��Ԫ�صĻ�̬ԭ���У�Fԭ�ӵĵ��Ӳ�������Һ�A����ͬһ���壮�ش��������⣺
��C,D,E����Ԫ�صĻ�̬ԭ�Ӿ�����ͬ�ĵ��Ӳ�������Eԭ�ӵ�p����ϵ�������Dԭ�ӵ�p����϶�һ�����ӣ�6��Ԫ�صĻ�̬ԭ���У�Fԭ�ӵĵ��Ӳ�������Һ�A����ͬһ���壮�ش��������⣺
��1���õ���ʽ��ʾA��E�γɻ�����Ĺ��� ��
��2��д��Fԭ�ӵĺ�������Ų�ʽ ��
��3��д��A2D�ĵ���ʽ �� �����������������������Ҽ�������������������м���
���𰸡�
��1��![]()
��2��1s22s22p63s23p64s1
��3���� ![]() ����������
����������
���������⣺ԭ������С��20��A,B,C,D,E,F����Ԫ�أ����ǵ�ԭ������������������BԪ���ǵؿ��к�����ߵ�Ԫ�أ���BΪOԪ�أ�B��DԪ�صļ۵�����Ҳ��ͬ����DΪSԪ�أ�A��C��Ԫ��ԭ�Ӻ��������֮����B��D��Ԫ��ԭ�Ӻ���������֮�͵� ![]() ����A,C����ԭ�ӵĺ��������֮��Ϊ��8+16����
����A,C����ԭ�ӵĺ��������֮��Ϊ��8+16���� ![]() =12����A��CԪ�صļ۵�������ͬ����AΪHԪ�ء�CΪNaԪ�أ�C,D,E����Ԫ�صĻ�̬ԭ�Ӿ�����ͬ���ܲ�������Eԭ�ӵ�p�ܼ��ϱ�Dԭ�ӵ�p�ܼ��϶�һ�����ӣ���EΪClԪ�أ�����Ԫ�صĻ�̬ԭ���У�Fԭ�ӵĵ��Ӳ�������Һ�A����ͬһ���壬���ڵ������ڣ�ΪKԪ�أ���1��AΪH,EΪClԪ�أ������γɵĻ�����ΪHCl��HClΪ���ۻ������ԭ������������Cl���������γ�һ�Թ��õ��Ӷԣ����γɹ��̿�дΪ��
=12����A��CԪ�صļ۵�������ͬ����AΪHԪ�ء�CΪNaԪ�أ�C,D,E����Ԫ�صĻ�̬ԭ�Ӿ�����ͬ���ܲ�������Eԭ�ӵ�p�ܼ��ϱ�Dԭ�ӵ�p�ܼ��϶�һ�����ӣ���EΪClԪ�أ�����Ԫ�صĻ�̬ԭ���У�Fԭ�ӵĵ��Ӳ�������Һ�A����ͬһ���壬���ڵ������ڣ�ΪKԪ�أ���1��AΪH,EΪClԪ�أ������γɵĻ�����ΪHCl��HClΪ���ۻ������ԭ������������Cl���������γ�һ�Թ��õ��Ӷԣ����γɹ��̿�дΪ�� ![]() �� ���Դ��ǣ�
�� ���Դ��ǣ� ![]() ����2��FΪKԪ�أ�ԭ�Ӻ�����19�����ӣ�Kԭ�ӵĺ�������Ų�ʽ��1s22s22p63s23p64s1 ��
����2��FΪKԪ�أ�ԭ�Ӻ�����19�����ӣ�Kԭ�ӵĺ�������Ų�ʽ��1s22s22p63s23p64s1 ��
���Դ��ǣ�1s22s22p63s23p64s1����3��A2DΪH2S������Ϊ���ۻ���������ʽΪ ![]() ��������к�������H��S�������ڦм���
��������к�������H��S�������ڦм���
���Դ��ǣ� ![]() ������������
������������