题目内容
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是


| A.HA为一元强酸 |
| B.N点水的电离程度小于K点水的电离程度 |
C.随着MOH溶液的滴加,比值 不变 不变 |
| D.若K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L |
B
试题分析:0.01mol?L-1 HA溶液中pH=2,则HA是强酸,N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,酸或碱性溶液抑制水电离,含有弱根离子的盐促进水电离,根据物料守恒计算K点c(MOH)和c(M+)的和。A、0.01mol?L-1 HA溶液中pH=2,则HA是强酸,故A正确;B、N点溶液呈中性,K点溶液呈碱性,碱性溶液抑制水电离,所以N点水的电离程度大于K点水的电离程度,故B错误;C、N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,温度不变,则弱碱的电离常数不变,因此
 ,C正确;D、在K点时混合溶液体积是碱溶液的2倍,根据物料守恒结合溶液体积变化知,c(MOH)+c(M+)=0.01mol?L-1,根据电荷守恒得c(M+)+c(H+)=c(OH-)+c(A-),c(MOH)+c(OH-)-c(H+)=c(M+)-c(A-)+c(MOH)=0.01mol?L-1-0.005mol?L-1=0.005mol?L-1,故D正确,故选D。
,C正确;D、在K点时混合溶液体积是碱溶液的2倍,根据物料守恒结合溶液体积变化知,c(MOH)+c(M+)=0.01mol?L-1,根据电荷守恒得c(M+)+c(H+)=c(OH-)+c(A-),c(MOH)+c(OH-)-c(H+)=c(M+)-c(A-)+c(MOH)=0.01mol?L-1-0.005mol?L-1=0.005mol?L-1,故D正确,故选D。
练习册系列答案
相关题目

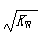
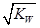 B. 混合液中:c(HA)+c(A-)=a mol·L-1
B. 混合液中:c(HA)+c(A-)=a mol·L-1 
 N2(g)+3H2(g),
N2(g)+3H2(g),
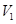 LpH=11的NaOH溶液与
LpH=11的NaOH溶液与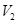 LpH=3的HA溶液混合后显中性,则
LpH=3的HA溶液混合后显中性,则