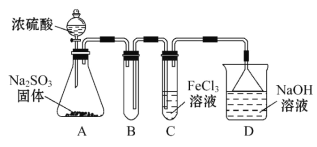
题目内容
【题目】工业上利用铁的氧化物在高温条件下循环裂解水制氢气的流程如下图所示。
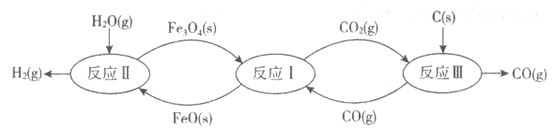
(1)反应I的化学方程式为:Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
(2)反应III为:CO2(g)+C(s)![]() 2CO(g)
2CO(g) ![]() H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
(3)上述流程中铁的氧化物可用来制备含有Fe3+的刻蚀液,用刻蚀液刻蚀铜板时,可观察到溶液颜色逐渐变蓝,该反应的离子方程式为_________。刻蚀液使用一段时间后会失效,先加酸,再加入过氧化氢溶液,可实现刻蚀液中Fe3+的再生,该反应的离子方程式为_________。
(4)上述流程中碳的氧化物可用来制备碳酰肼[CO(NHNH2)2,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式为_________。
【答案】3FeO(s)+H2O(l) ![]() H2(g)+Fe3O4(s) 催化剂 C(s)+H2O(g)=CO(g)+H2(g)(方程不写状态,写可逆号亦可) 升高温度,减小压强,移走CO,加入CO2等 2Fe3++Cu=2Fe2++Cu2+ H2O2+2Fe2++2H+=2H2O+2Fe3+ CO(NHNH2)2+12Fe2O38Fe3O4+2N2↑+CO2↑+3H2O
H2(g)+Fe3O4(s) 催化剂 C(s)+H2O(g)=CO(g)+H2(g)(方程不写状态,写可逆号亦可) 升高温度,减小压强,移走CO,加入CO2等 2Fe3++Cu=2Fe2++Cu2+ H2O2+2Fe2++2H+=2H2O+2Fe3+ CO(NHNH2)2+12Fe2O38Fe3O4+2N2↑+CO2↑+3H2O
【解析】
(1)由流程图可获取化学反应的反应物和生成物相关信息,再结合原子守恒和电子守恒进行分析解答;
(2)反应III为:CO2(g)+C(s)![]() 2CO(g) ΔΗ>0,该反应正反应为一个气体分子数目增多的吸热反应,提高达平衡后CO的产量,则需要促使平衡正向移动,由化学平衡移动原理分析解答;
2CO(g) ΔΗ>0,该反应正反应为一个气体分子数目增多的吸热反应,提高达平衡后CO的产量,则需要促使平衡正向移动,由化学平衡移动原理分析解答;
(3)用刻蚀液刻蚀铜板时的反应为:2Fe3++Cu=2Fe2++Cu2+,刻蚀液中Fe3+的再生,即将亚铁离子氧化又生成铁离子,由此解答;
(4)由题给信息分析出该反应的反应物和生成物,再结合氧化还原反应方程式的配平方法可解答。
(1)由流程图可知反应II的反应物为FeO(s)和H2O(g),生成物为H2(g)和Fe3O4(s),配平可得方程式3FeO(s)+H2O(g)![]() H2(g)+Fe3O4(s);反应I为:Fe3O4(s)+CO(g)
H2(g)+Fe3O4(s);反应I为:Fe3O4(s)+CO(g) ![]() 3FeO(s)+CO2(g),反应II为:3FeO(s)+H2O(g)
3FeO(s)+CO2(g),反应II为:3FeO(s)+H2O(g)![]() H2(g)+Fe3O4(s),综合两反应可知铁的氧化物虽然参与了反应,但在反应前后并没有发生变化,起到催化剂的作用;由流程图可知,整个过程的反应物为C(s)和H2O(g),生成物为CO(g)和H2(g),则反应I、II、III的总结果为:C(s)+H2O(g)
H2(g)+Fe3O4(s),综合两反应可知铁的氧化物虽然参与了反应,但在反应前后并没有发生变化,起到催化剂的作用;由流程图可知,整个过程的反应物为C(s)和H2O(g),生成物为CO(g)和H2(g),则反应I、II、III的总结果为:C(s)+H2O(g)![]() CO(g)+H2(g);故答案为:3FeO(s)+H2O(g)
CO(g)+H2(g);故答案为:3FeO(s)+H2O(g) ![]() H2(g)+Fe3O4(s)、催化剂、C(s)+H2O(g)
H2(g)+Fe3O4(s)、催化剂、C(s)+H2O(g)![]() CO(g)+H2(g)(方程不写状态,写可逆号亦可) ;
CO(g)+H2(g)(方程不写状态,写可逆号亦可) ;
(2)反应III为:CO2(g)+C(s)![]() 2CO(g) ΔΗ>0,该反应正反应为一个气体分子数目增多的吸热反应,提高达平衡后CO的产量,则需要促使平衡正向移动,由化学平衡移动原理可知;在其它条件不变时,升高温度、减小压强、移走CO或加入CO2等都可使平衡正向移动,提高达平衡后CO的产量,故答案为:在其它条件不变时,升高温度、减小压强、移走CO或加入CO2等(任写一条措施);
2CO(g) ΔΗ>0,该反应正反应为一个气体分子数目增多的吸热反应,提高达平衡后CO的产量,则需要促使平衡正向移动,由化学平衡移动原理可知;在其它条件不变时,升高温度、减小压强、移走CO或加入CO2等都可使平衡正向移动,提高达平衡后CO的产量,故答案为:在其它条件不变时,升高温度、减小压强、移走CO或加入CO2等(任写一条措施);
(3)用刻蚀液刻蚀铜板时,可观察到溶液颜色逐渐变蓝,是因为生成了Cu2+,发生的离子反应为:2Fe3++Cu=2Fe2++Cu2+;在酸性条件下,双氧水可将Fe2+氧化生成Fe3+,从而实现刻蚀液的再生,发生的离子反应为:H2O2+2Fe2++2H+=2H2O+2Fe3+;故答案为:2Fe3++Cu=2Fe2++Cu2+;H2O2+2Fe2++2H+=2H2O+2Fe3+;
(4)由题给信息可知该反应的反应为:CO(NHNH2)2和Fe2O3,生成物有Fe3O4、N2、CO2、H2O等,由氧化还原反应的规律配平可得方程式CO(NHNH2)2+12Fe2O38Fe3O4+2N2↑+CO2↑+3H2O;故答案为:CO(NHNH2)2+12Fe2O38Fe3O4+2N2↑+CO2↑+3H2O。