题目内容
( 17分)欲配制1 mol/L的氢氧化钠溶液250mL,
(1)实验室所需的仪器有: , , , , 。
(2)完成下列步骤:
①称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中,加少量蒸馏水将其溶解,待冷却后将溶液沿 移入 中。
③用少量蒸馏水洗涤 次,将洗涤液转移入 中,在操作过程中不损失点滴液体,否则会使溶液的浓度偏 (高或低)。
④加水定容过程中离刻度线 时,改用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏 ,应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入试剂瓶中并贴好标签。
(1):托盘天平,烧杯,玻璃棒,250ml容量瓶,胶头滴管
(2):10.0g 烧杯 玻璃棒 250ml容量瓶 2-3次 容量瓶 低
1-2cm 胶头滴管 低 重新配置 摇匀 试剂瓶
解析

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案(17分)某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。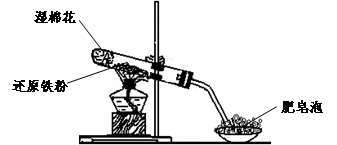
已知:①FeO + 2H+ = Fe2+ + H2O②Fe2O3 + 6H+ = 2Fe3+ +3 H2O ③Fe3O4 + 8H+ = Fe2+ +2Fe3+ +4 H2O
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为 。
(2)该同学欲确定反应一段时间后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意) ,若溶液未变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意) 。
| A.一定有Fe3O4,可能有Fe | B.只有Fe(OH)3 | C.一定有Fe3O4和Fe |
| D.一定有Fe(OH)3,可能有Fe E.只有Fe3O4 |
(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按下图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式 。

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+ 具有 性。由此可知,实验室中含Fe2+的盐溶液需现用现配制的原因是 ,并且配制含Fe2+的盐溶液时应加入少量 。
(6)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用右图所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应。获得不含O2的蒸馏水的方法是______________。反应开始时,打开止水夹的目的是___________________________________;一段时间后,关闭止水夹,在试管_______(填“A”或“B”)中观察到白色的Fe(OH)2







