题目内容
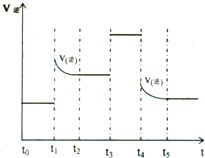
 右图是反应A2 +B2
右图是反应A2 +B2![]() 2AB 在不同温度和压强下,AB体积分数(AB%)的变化情况,其中a、b 曲线为相同压强、不同温度时的变化情况,c 曲线在保持与b 相同温度时从时间t3 开始增大压强的情况,则下列叙述正确的是
2AB 在不同温度和压强下,AB体积分数(AB%)的变化情况,其中a、b 曲线为相同压强、不同温度时的变化情况,c 曲线在保持与b 相同温度时从时间t3 开始增大压强的情况,则下列叙述正确的是
A.A2 、B2 、AB 均为气体,正反应放热
B.AB 为气体,A2 、B2 中最少有一种为非气体,正反应放热
C. AB 为气体,A2 、B2 中:最少有一种为非气体,正反应吸热
D.AB 为固体,A2 、B2 中最少有一种为气体,正反应吸热
C
解析:
本题主要考查了化学平衡移动的知识。属于中等难度题。若A2 、B2 、AB 均为气体,则增大压强时AB体积分数不变,故A错,增大压强AB%变小说明平衡向逆反应方向移动,因此AB 必为气体,而且A2 、B2 中最少有一种为非气体。又因t1<t2,故a的温度大于b的温度,AB体积分数从b到a又增大,因此正反应是吸热;选C。

练习册系列答案
相关题目
右图是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.A2+与D2-的核外电子数相等
B.B与E形成的化合物具有两性
C.氢化物的稳定性为H2E<H2D
D.C单质与浓度相等的稀盐酸反应比A快

 (2009?安徽模拟)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+1,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物.回答下列问题:
(2009?安徽模拟)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+1,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物.回答下列问题: