题目内容
【题目】碳酸钠、碳酸氢钠和氯化钠的固体混合物共4 g,把它们加强热到质量不再减轻为止,冷却后称重为3.38 g。在残余固体中加入过量的盐酸,产生二氧化碳0.88 g。回答下列问题:
(1)固体质量减轻了__________g,这是因为发生了反应__________________________(写化学方程式),从化学方程式可计算出原混合物中碳酸氢钠的质量是__________g,加热后新增加了碳酸钠__________g。
(2)残余固体中加入过量盐酸的化学方程式为__________________,通过已知条件“产生的二氧化碳为0.88 g”可以计算出参加反应的碳酸钠是____________g,因为其中有____________g 碳酸钠是加热碳酸氢钠产生的,故原混合物中含碳酸钠____________g。
(3)原混合物中含氯化钠____________g。
【答案】0.62 2NaHCO3![]() Na2CO3+H2O+CO2↑ 1.68 1.06 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 2.12 1.06 1.06 1.26
Na2CO3+H2O+CO2↑ 1.68 1.06 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 2.12 1.06 1.06 1.26
【解析】
由于混合物中发生反应2NaHCO3![]() Na2CO3+H2O+CO2↑,导致固体质量减少,利用差量法计算原混合物中NaHCO3的质量、生成碳酸钠的质量,利用反应Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据CO2的质量可计算加热后总的Na2CO3的质量,减去NaHCO3分解生成的Na2CO3的质量即可得原混合物中Na2CO3的质量。
Na2CO3+H2O+CO2↑,导致固体质量减少,利用差量法计算原混合物中NaHCO3的质量、生成碳酸钠的质量,利用反应Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据CO2的质量可计算加热后总的Na2CO3的质量,减去NaHCO3分解生成的Na2CO3的质量即可得原混合物中Na2CO3的质量。
(1)加热发生反应:2NaHCO3![]() Na2CO3+H2O+CO2↑导致固体质量减少,质量减少:4g-3.38g=0.62g,设混合物中有NaHCO3的质量为x,生成Na2CO3的质量为y,
Na2CO3+H2O+CO2↑导致固体质量减少,质量减少:4g-3.38g=0.62g,设混合物中有NaHCO3的质量为x,生成Na2CO3的质量为y,
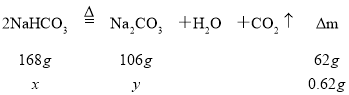
解得x=1.68g,y=1.06g,故答案为:0.62g;2NaHCO3![]() Na2CO3+H2O+CO2↑;1.68;1.06;
Na2CO3+H2O+CO2↑;1.68;1.06;
(2)在残余固体中加入过量的盐酸,产生二氧化碳0.88g,即0.02mol,根据碳守恒,和盐酸反应的加热后碳酸钠的总物质的量为0.02mol,质量是0.02mol×106g/mol=2.12g。则原混合物中碳酸钠的质量=2.12g-1.06g=1.06g,故答案为:Na2CO3+2HCl=2NaCl+CO2↑+H2O;2.12g ;1.06g;1.06g;
(3)原混合物中含碳酸氢钠的质量为1.68g,碳酸钠的质量为1.06g,则氯化钠的质量=4g-1.68g-1.06=1.26g,故答案为:1.26g;

【题目】近年科学家提出“绿色自由”构想。把空气中的CO2进行转化,并使之与H2反应生成可再生能源甲醇。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①下列关于氢能的说法正确的是____。
A.氢能是清洁能源 B.氢能是二次能源
C.氢能是不可再生能源 D.气态氢能源更容易保存和运输
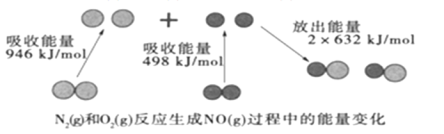
②已知CO(g)和H2(g)的燃烧热(△H)分别为-283.0kJmol-1、-285.8kJmol-1。CO与H2合成甲醇的能量变化如图甲所示:
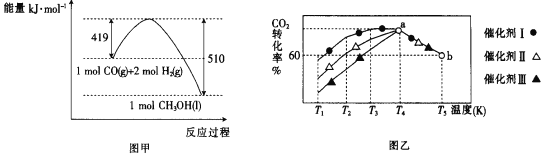
则用CO2(g)和H2(g)制备液态甲醇的热化学方程式为____。
③将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率与温度的变化如图乙所示:催化效果最好的是催化剂____(选填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)利用CO和水蒸气可生产H2,反应的化学方程式:CO(g)+H2O(g)CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应,得到三组数据如表所示:
温度/℃ | 起始量 | 达到平衡 | |||
CO/mol | H2O/mol | H2/mol | CO转化率 | 时间/min | |
650 | 4 | 2 | 1.6 | 10 | |
900 | 3 | 2 |
| 5 | |
900℃时,达到平衡时的反应速率v(H2O)=____。(保留2位小数)。
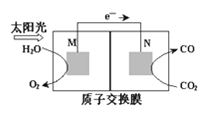
(3)科学家还研究了其他转化温室气体的方法,利用如图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为____。