题目内容
2.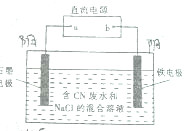 工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:
工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:①CN--2e-+2OH-═CNO-+H2O
②2Cl--2e-═Cl2↑
③3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O
下列说法不正确的是( )
| A. | a是电源的正极 | |
| B. | 铁电极上发生的电极反应式为2H++2e-═H2↑ | |
| C. | 为了使电解池连续工作,需要不断补充NaOH | |
| D. | 除去1mol CN-,电解过程中共产生标准状况下11.2L气体 |
分析 根据发生的电极反应,可以知道金属铁是阴极,石墨电极是阳极,根据电解质中离子的放电顺序以及电极反应和电子的转移知识来回答即可.
解答 解:A、金属铁是阴极,石墨电极是阳极,与a相连的为石墨电极,所以a是电源的正极,故A正确;
B、金属铁是阴极,为溶液中的氢离子得电子发生还原反应,电极反应式为2H++2e-═H2↑,故B正确;
C、根据电极反应的离子,为了使电解池连续工作,需要补充氢氧化钠,故C正确;
D、根据反应:3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O,除去1mol CN-,消耗1.5mol氯气,生成0.5mol氮气,所以电解过程中共产生标准状况下(1.5+0.5)×22.4=44.8L气体,故D错误.
故选D.
点评 本题考查学生电解池的工作原理以及电极反应式等,注意把握电解池的工作原理,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.下列各种用途中,利用了物质的氧化性的是( )
| A. | 用食盐腌制食物 | B. | 用盐酸除去铁钉表面的铁锈 | ||
| C. | 用液氨作制冷剂 | D. | 用漂粉精消毒游泳池中的水 |
13.化学反应A(g)+3B(g)=2C(g)+2D(g),下列四个选项是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最快的是( )
| A. | υ(A)=0.20mol/(L•min) | B. | υ(B)=0.45 mol/(L•min) | ||
| C. | υ(C)=0.30 mol/(L•min) | D. | υ(D)=0.35 mol/(L•min) |
10.下列实验操作或实验事故处理正确的是( )
| A. | 实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中 | |
| B. | 实验室制硝基苯时,将硝酸与苯混合后再滴加浓硫酸 | |
| C. | 实验时手指上不小心沾上苯酚,立即用70℃以上的热水清洗 | |
| D. | 苯中含苯酚杂质,除去杂质的方法:加入溴水,过滤 |
17.下列关于物质性质变化的比较,不正确的是( )
| A. | 原子半径大小:Na>S>O | B. | 稳定性:HI>HBr>HCl>HF | ||
| C. | 碱性强弱:KOH>Ca(0H)2>Mg(OH)2 | D. | 还原性强弱:I一>CI一>F? |
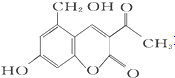
7.化合物M叫假蜜环菌素,它是香豆素类天然化合物.下列对M的叙述中错误( )
 M(假蜜环菌素)
M(假蜜环菌素)
 M(假蜜环菌素)
M(假蜜环菌素)| A. | M的分子式为C12H10O5 | |
| B. | 1 mol M最多可和6mol H2发生加成反应 | |
| C. | M可发生水解反应 | |
| D. | M可与 HBr反应 |
14.在A、B、C三支试管中分别加入等体积0.1 mol/L Fe2(SO4)3溶液.将A试管在酒精灯火焰上加热到沸腾,向B试管中加3滴6 mol/L H2SO4.下列说法不正确的是( )
| A. | 最终三支试管的颜色各不相同 | |
| B. | A试管中Fe(OH)3含量最高 | |
| C. | 直接加热蒸发Fe2(SO4)3溶液可得到Fe2(SO4)3晶体 | |
| D. | B试管中Fe2(SO4)3不能发生水解 |
4.化学与人类生活、生成和社会可持续发展密切相关,下列说法正确的是( )
| A. | 铜矿石在细菌作用下直接转换为单质铜,这个过程中叫做生物炼铜 | |
| B. | 人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,相同条件下,某物质的热值越高,其标准燃烧越大 | |
| C. | 铅蓄电池是最常见的二次电池,可根据硫酸的密度来判断铅蓄电池是否需要充电 | |
| D. | “地沟油”禁止食用,但可以通过物理变化制肥皂 |
 .
.