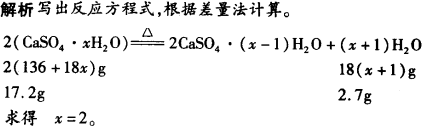题目内容
|
17.2 g CaSO4·xH2O转变成2CaSO4·(x-1)H2O时,质量减少2.7 g,则x值是( ). | |
| [ ] | |
A. |
1 |
B. |
2 |
C. |
4 |
D. |
6 |
解析:
|
|
提示:
|
要注意2(CaSO4·xH2O)与2CaSO4·(x-1)H2O的区别,前者含2xH2O,后者含(x-1)H2O. |

|
17.2 g某硫酸钙的结晶水合物,加热使其失去全部结晶水,得固体质量13.6 g,该结晶水合物的化学式为 | |
| [ ] | |
A. |
CaSO4·H2O |
B. |
CaSO4·2H2O |
C. |
CaSO4·3H2O |
D. |
CaSO4·5H2O |
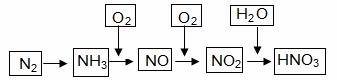
工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应如下图所示:
 |
请回答:
(1)NO2与H2O反应中的还原剂是 。
(2)NH3与O2制取NO的化学反应方程式 。
(3)下列说法不正确的是(选填序号字母) 。
a.氨可用作制冷剂
b.铵态氮肥一般不能与碱性化肥共同使用
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol NO2
(4)大量排放含N、P化合物的废水,会导致水体污染。其中含氮的物质主要是蛋白质,蛋白质在水中分解会产生氨气,氨气在微生物的作用下与氧气反应生成HNO2,上述氨气与氧气的反应中,氧化剂与还原剂的物质的量之比为 。
(5)已知:
H2(g) + ![]() O2(g) = H2O(g) △H1 = 241.8 kJ/mol
O2(g) = H2O(g) △H1 = 241.8 kJ/mol
![]() N2(g) + O2(g) = NO2 (g) △H2 = +33.9 kJ/mol
N2(g) + O2(g) = NO2 (g) △H2 = +33.9 kJ/mol
![]() N2(g) +
N2(g) + ![]() H2(g) = NH3 (g) △H3 = 46.0kJ/mol
H2(g) = NH3 (g) △H3 = 46.0kJ/mol
则17g氨气与氧气反应生成NO2(g)与H2O(g)时,△H= kJ/mol。
(6)氨气是氮肥工业的重要原料,某化肥厂生产铵态氮肥(NH4) 2SO4的工艺流程如下:
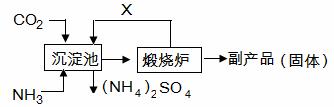 |
向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因是 。