��Ŀ����
����Ŀ��ǰ36��Ԫ���е�A��B��C��D��E��F��ԭ��������������ֻ��ǰ����Ϊ������Ԫ�ء�A��B��ԭ�Ӻ���s����������p�����������: Cԭ�Ӻ�������p���ȫ�������: DԪ�ص����������������IJ�Ϊ4;E��ǰ�������е縺����С��Ԫ��:F�����ڱ��ĵ���������������������Ϣ���ش���������.
��1��A���ӵĵ��ӹ�ռ��_____�������AԪ������Ȼ���еĴ�����̬_____(a ֻ�л���̬��bֻ������̬��c������)��
��2��ij�˻���B�ĵ����Ų�ͼ��ͼ![]() ��Υ����________ԭ����
��Υ����________ԭ����
��3��Fλ��______�壬���̬ԭ�ӵĵ�����_____���˶�״̬��
��4��CD3����ԭ�ӵ��ӻ���ʽΪ____���ü۲���ӶԻ��������Ʋ�����ӿռ乹��Ϊ____������EԪ�صķ�����___________��
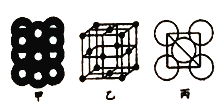
��5����ij�������ʾ�����ԭ�ӵĶѻ���ʽ��ͼ����ʾ����Ʒ��������ͼ����ʾ��ԭ��֮���λ�ù�ϵ��ƽ��ͼ��ͼ����ʾ.���и�ԭ�ӵ���λ��Ϊ______���õ��ʾ�����ԭ�ӵĶѻ���ʽΪ���ֻ����ѻ���ʽ�е�________������֪�ý�����ԭ�Ӱ뾶Ϊdcm,NA���������ӵ����������������ԭ������ΪM,��þ�����ܶ�Ϊ________g/cm3(����ĸ��ʾ)��
���𰸡� 5 c ���������� ��B 25 sp3 ������ ��ɫ��Ӧ 12 �����������ܶѻ� ![]()
��������ǰ36��Ԫ���е�A��B��C��D��E��F��ԭ��������������ֻ��ǰ����Ϊ������Ԫ�ء�A��B��ԭ�Ӻ���s����������p���������������A�ĺ�������Ų�Ϊ��1s22s22p2��AΪO��B�ĺ�������Ų�Ϊ��1s22s22p63s2��BΪMg��Cԭ�Ӻ�������p���ȫ���������ԭ����������Mg�����������Ų�Ϊ1s22s22p63s23p3����CΪPԪ�أ�DԪ�ص����������������IJ�Ϊ4��ԭ����������P����DΪ�������ڵ���A��Ԫ�أ���DΪCl��E��ǰ�������е縺����С��Ԫ�أ���EΪK��F���ڵ������ڣ����ڵ����У���FΪMn��
��.AΪO�������ӵĺ�������Ų�ʽΪ��1s22s22p4�����������ӵĵ��ӹ�ռ��5���������Ԫ������Ȼ���м��е��������������ȣ�Ҳ��ˮ��������̼������Ԫ�ع��ɵĻ��������ʴ�Ϊ��5��c��
��.������ԭ����֪��������ͬһ����ڵ���������Ӧ�෴��B��̬ԭ�ӵĺ�������Ų�ͼ��3s�ϵ�������������������ͬ����Υ��������������ԭ�����ʴ�Ϊ�����������ݣ�
��.FΪMn�����ڵ������ڣ����ڵ����У�Ϊ��B��Ԫ�أ����������Ϊ25����25���˶�״̬��ͬ�ĵ��ӣ��ʴ�Ϊ����B��25��
��. PCl3��Pԭ�ӹµ��Ӷ���Ϊ1���ɼ���Ϊ3����Ϊsp3�ӻ������ü۲���ӶԻ��������Ʋ���ռ乹��Ϊ�����Σ�EΪK������KԪ��Ӧ������ɫ��Ӧ���ʴ�Ϊ��sp3�������Σ���ɫ��Ӧ��
��. �ɾ����ṹ��֪���Զ���ԭ���о�����֮�����ԭ�Ӵ��������ϣ�ÿ������ԭ��Ϊ12���湲�ã��ʾ����и�ԭ�ӵ���λ��Ϊ12���õ��ʾ�����ԭ�ӵĶѻ���ʽΪ�����������ܶѻ���
�����ı߳�Ϊ![]() ��4dcm=2
��4dcm=2![]() dcm�����Ծ��������Ϊ(2
dcm�����Ծ��������Ϊ(2![]() dcm)3�����ݾ�̯����֪��ÿ�������к��е�ԭ����Ϊ8��
dcm)3�����ݾ�̯����֪��ÿ�������к��е�ԭ����Ϊ8��![]() +6��
+6��![]() =4��������Ϊ4��
=4��������Ϊ4��![]() g�����Ծ������ܶ�Ϊ4��
g�����Ծ������ܶ�Ϊ4��![]() g��(2
g��(2![]() dcm)3=
dcm)3=![]() gcm3��
gcm3��
�ʴ�Ϊ��12�������������ܶѻ��� ![]() ��
��

����Ŀ�����к͵ζ����ⶨij��������ʵ���Ũ�ȡ�
��1������ҺӦʢ��___________(����A������B��)�ζ����С�
��2����ѡ�÷�̪��ָʾ������0.1250 mol��L-1�ı�����������Һ�ζ�������жϵζ��յ�____________��
��3��ʵ�����ݼ�¼���±�����������ݲ����㣬��������ʵ���Ũ��=_________mol��L-1��

�ζ����� | ������Һ���/mL | ||
����Һ | |||
�ζ�ǰ����/mL | �ζ������/mL | ||
1 | 20.00 | 0.00 | 16.02 |
2 | 20.00 | 0.00 | 15.98 |
3 | 20.00 | 0.00 | 16.00 |
����Ŀ������A��B��C��D���ֶ����ڷǽ���Ԫ�أ����ǵ�ԭ������������֮��Ϊ19�������ǵĻ������У���Ҫ���ϼ۾���ֹһ�֣�����һ����ͬ�Ļ��ϼۣ����ǵIJ����������£�
Ԫ�� | A | B | C | D |
ԭ�Ӱ뾶/nm | 0.102 | 0.077 | 0.117 | 0.075 |
��������ϼ� | ��4 | +4 |
��1��AԪ����Ԫ�����ڱ��е�λ��Ϊ ��
��2����DԪ�ص����ֳ������ۻ���������Ϸ�Ӧ������һ�����ӻ�����÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3��B�ĵ�����D������������Ӧ��ˮ�����ڼ��������·�����Ӧ�Ļ�ѧ����ʽΪ ��
��4��C������Al����ijЩ�����ԣ���������ǿ�Ӧ��д��C������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ�� ��
��5��A��B��C��D�����γɷ����к�18���ӵ��⻯���Щ�⻯��ķ���ʽ�ֱ�Ϊ ��