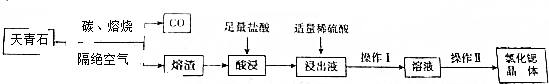
题目内容
8.甲醇是重要的化工原料,又可作为燃料,应用十分广泛.回答下列问题:(1)利用合成气在催化剂作用下合成甲醇,发生的主要反应如下:
Ⅰ.CO(g)+2H2(g)?CH3OH(g)△H1
Ⅱ.CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41kJ•mol-1
Ⅲ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3
已知反应Ⅰ中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
分析 反应热=反应物总键能-生成物总键能;根据盖斯定律:反应Ⅱ+反应Ⅰ=反应Ⅲ,反应热也进行相应的计算.
解答 解:反应热=反应物总键能-生成物总键能,故△H1=1076kJ.mol-1+2×436kJ.mol-1-(3×413+343+465)kJ.mol-1=-99kJ.mol-1;
根据盖斯定律:反应Ⅱ+反应Ⅰ=反应Ⅲ,故△H3=△H2+△H1=+41kJ•mol-1+(-99kJ.mol-1)=-58kJ.mol-1,
故答案为:-58.
点评 本题考查反应热有关计算,侧重考查学生分析计算能力,需要学生具备扎实的基础,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:
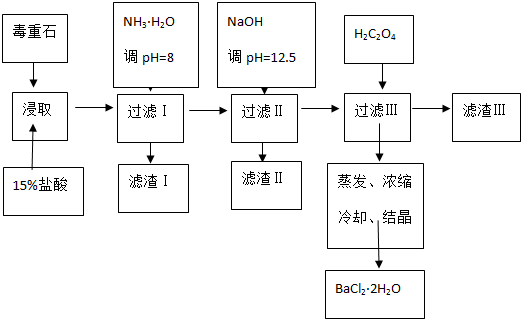
(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)已知:
加入NH3•H2O调节pH=8可除去Fe3+;(填离子符号),滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
已知:Ksp(BaC2O4)=1.610-7,Ksp(CaC2O4)=2.310-9
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+═Cr2O72-+H20 Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用bmol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
试回答:滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为$\frac{(V{\;}_{0}-V{\;}_{1})b}{y}$mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).

(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)已知:
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)=1.610-7,Ksp(CaC2O4)=2.310-9
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+═Cr2O72-+H20 Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用bmol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
试回答:滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为$\frac{(V{\;}_{0}-V{\;}_{1})b}{y}$mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).
19.在下列各溶液中,一定可以大量共存的离子组是( )
| A. | 室温下,pH=1的溶液中:K+、Fe2+、ClO-、SO42- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液:Cu2+、Na+、SO42-、NO3- | |
| C. | 加入铝粉产生大量氢气的溶液中:Na+、NH4+、NO3-、SO42- | |
| D. | 在0.1 mol•L-1 Fe3+溶液中:K+、Na+、HCO3-、SO42- |
16.关于常温下pH=2的醋酸溶液,下列叙述正确的是( )
| A. | c(CH3COOH)+c(CH3COO-)=0.01mol•L-1 | |
| B. | c(H+)=c(CH3COO-) | |
| C. | 加水稀释100倍后,溶液pH=4 | |
| D. | 加入醋酸钠固体,可抑制醋酸的电离 |
13.已知:2Fe+xC+yO2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCO3,下列关于该反应的说法正确的是( )
| A. | 铁元素被氧化,碳元素被还原 | |
| B. | 当有1mol O2参与反应时,消耗$\frac{2}{3}$mol Fe | |
| C. | x=4,y=3 | |
| D. | 每生成1mol FeCO3,转移电子4mol |
2.化学与社会、生活密切相关,下列有关说法正确的是( )
| A. | 氮化硅陶瓷、有机玻璃是传统无机非金属材料 | |
| B. | 瓷坩埚能耐高温,可以用于加热分解石灰石 | |
| C. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 | |
| D. | SO2具有氧化性,可用于漂白纸浆 |
19.将碘水倒入汽油中,振荡、静置.下列现象描述正确的是( )
| A. | 汽油在上层,水在下层,汽油层呈无色 | |
| B. | 汽油在下层,水在上层,汽油层呈紫色 | |
| C. | 汽油在上层,水在下层,水层呈无色 | |
| D. | 汽油在上层,水在下层,水层呈紫色 |
20. 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
(1)COCl2的空间构型为平面三角形;溴的价电子排布式为4s24p5.
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式分解. A.CsICl2$\frac{\underline{\;\;△\;\;}}{\;}$CsCl+ICl B.CsICl2$\frac{\underline{\;\;△\;\;}}{\;}$CsI+Cl2
(3)根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘.
(4)下列分子既不存在s-p σ键,也不存在p-p π键的是D.
A.HCl B.HF C.SO2 D.SCl2
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中中心氯原子的杂化轨道类型为sp3杂化,写出与CN-互为等电子体的分子:N2或 CO(写出1个).
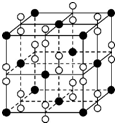
(6)钙在氧气中燃烧时得到一种钙的氧化物固体,其结构如图所示.由此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρ g•cm-3,则晶胞中离得最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{72×4}{ρN{\;}_{A}}}$ cm(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA).
 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.(1)COCl2的空间构型为平面三角形;溴的价电子排布式为4s24p5.
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式分解. A.CsICl2$\frac{\underline{\;\;△\;\;}}{\;}$CsCl+ICl B.CsICl2$\frac{\underline{\;\;△\;\;}}{\;}$CsI+Cl2
(3)根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘.
| 氟 | 氧 | 溴 | 碘 | |
| 第一电离能 (kJ/mol) | 1 681 | 1 251 | 1 140 | 1 008 |
A.HCl B.HF C.SO2 D.SCl2
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中中心氯原子的杂化轨道类型为sp3杂化,写出与CN-互为等电子体的分子:N2或 CO(写出1个).
(6)钙在氧气中燃烧时得到一种钙的氧化物固体,其结构如图所示.由此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρ g•cm-3,则晶胞中离得最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{72×4}{ρN{\;}_{A}}}$ cm(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA).