题目内容
如图所示,实验装置具有良好的密封性,广口瓶A内的液体是适合新鲜的绿藻生活的Na2CO3和NaHCO3的混昆合溶液,实验开始前导管B中水柱的上面与烧杯C中的液面齐平.实验从用适宜的光照射广口瓶A开始.
请回答下列问题:

(1)Na2CO3和NaHCO3各起什么作用?写出有关化学反应的方程式.
(2)光照一段时间后,B管中的水柱将怎样变化?
(3)关掉光源将实验装置置于暗室内一段时间后,导管B中的水柱会怎样变化?
解析:
|
答案:(1)稳定广口瓶内气体中CO2的量.Na2CO3+CO2+H2O (2)下降. (3)上升. 解析:Na2CO3和NaHCO3通过在溶液中的化学反应Na2CO3+CO2+H2O |
提示:
|
该题可谓理、化、生综合题.化学知识主要是Na2CO3、NaHCO3、CO2的性质,生物学知识主要是植物的光合作用与呼吸作用,物理学知识主要是气体的量与压力的关系. |

 阅读快车系列答案
阅读快车系列答案(10分)
某课外兴趣小组探究铝与盐酸反应的反应速率与哪些因素有关。请填写下列空白:
(1)实验化学反应原理: 。
(2)实验用品:试管(普通试管和具支试管各一支)、镊子、乳胶管、玻璃导管、水槽、;稀盐酸(4mol/L)、铝条(片)、水、胶头滴管、温度计。
(3)实验装置(图中铁架台等夹持仪器略去)
(4)实验方法
①按如图所示连接好实验仪器,检查装置的气密性
②取3块铝条(足量)加入到试管中。
③在盛有铝条的试管中,加入2mL稀盐酸。
④测量试管中溶液的温度。
⑤收集反应产生的氢气。
(5)数据处理及问题讨论
①实验结束后,课外兴趣小组成员将产生氢气的体积与时间作了如下的图。
②试判断OE、EF、FG段所收集气体的多少。
OE: ;EF: ;FG: 。
写出这三段时间内产生氢气的速率大小比较(用OE、EF、FG 表示),并解释原因。
速率大小比较: 。原因:________
③如果反应太激烈,为了减缓反应速率而又不减少产生氢气
的量,他在盐酸中分别加入下列溶液:
| A.蒸馏水 | B.NaCl溶液 | C.Na2CO3溶液 | D.CuSO4溶液 E. NaNO3溶液 |

 某课外兴趣小组欲探究铝与盐酸反应的能量变化以及影响化学反应速率的因素.做如下实验,请填写下列空白:
某课外兴趣小组欲探究铝与盐酸反应的能量变化以及影响化学反应速率的因素.做如下实验,请填写下列空白: 煤的干馏是煤气化的重要方法,是煤综合利用最“古老”的方法,也是最简单的方法,所谓煤的干馏是在隔绝空气和高温的条件下,煤可以发生分解,生成固态的焦炭、液态的煤焦油、气态的焦炉气.下面是某实验小组设计的煤干馏实验,装置如图所示.取约2~3g的煤粒,在研钵中研磨至粉末状态;用药匙将煤粉放入玻璃管中,在具支试管中加入2mL水,然后按照如图所示安装好装置;点燃酒精灯,对玻璃管均匀受热后再集中受热,注意观察具支试管中气泡产生的速度;待具支试管中气泡产生的速度均匀后,用明火靠近具支试管的支管口处,可以观察到产生的气体能够燃烧.
煤的干馏是煤气化的重要方法,是煤综合利用最“古老”的方法,也是最简单的方法,所谓煤的干馏是在隔绝空气和高温的条件下,煤可以发生分解,生成固态的焦炭、液态的煤焦油、气态的焦炉气.下面是某实验小组设计的煤干馏实验,装置如图所示.取约2~3g的煤粒,在研钵中研磨至粉末状态;用药匙将煤粉放入玻璃管中,在具支试管中加入2mL水,然后按照如图所示安装好装置;点燃酒精灯,对玻璃管均匀受热后再集中受热,注意观察具支试管中气泡产生的速度;待具支试管中气泡产生的速度均匀后,用明火靠近具支试管的支管口处,可以观察到产生的气体能够燃烧.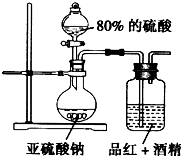 某研究性学习小组的同学决定通过实验探究SO2的漂白性是SO2本身具有的还是SO2与水作用的产物具有的,他们查阅资料知品红能溶解在酒精中形成红色溶液.
某研究性学习小组的同学决定通过实验探究SO2的漂白性是SO2本身具有的还是SO2与水作用的产物具有的,他们查阅资料知品红能溶解在酒精中形成红色溶液.