题目内容
7.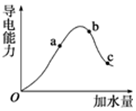 一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答.
一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答.①a、b、c三点的氢离子浓度由小到大的顺序为c<a<b.
②a、b、c三点中,醋酸的电离程度最大的一点是c.
③测得某醋酸溶液中氢离子浓度为0.004mol•L-1,则醋酸的电离度为4%,该温度下醋酸的电离平衡常数K=1.6×10-5.
分析 ①溶液的导电能力与离子浓度成正比;
②溶液越稀,醋酸的电离程度越大;
③电离度=$\frac{已电离的醋酸}{醋酸的总浓度}$×100%,根据Ka=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$计算.
解答 解:①溶液的导电能力与离子浓度成正比,根据图象知,溶液导电能力大小顺序是b>a>c,则氢离子浓度由小到大顺序是c<a<b,
故答案为:c<a<b;
②溶液越稀,醋酸的电离程度越大,根据图象知,溶液体积大小顺序是c>b>a,所以醋酸电离程度最大的是c,
故答案为:c;
③醋酸溶液中氢离子浓度为0.004mol•L-1,则醋酸的电离度=$\frac{已电离的醋酸}{醋酸的总浓度}$×100%=$\frac{0.004}{0.1}$×100%=4%,
醋酸的电离常数为Ka=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{0.004×0.004}{0.1-0.004}$=1.6×10-5;
故答案为:4%;1.6×10-5 .
点评 本题考查了弱电解质的电离、电离平衡常数的计算,明确溶液导电能力的影响因素、弱电解质电离程度与溶液浓度的关系是解本题关键,正确分析图象即可,题目难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
20.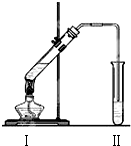 图是实验室制乙酸乙酯的装置.
图是实验室制乙酸乙酯的装置.
(1)加热前,通常需要在试管Ⅰ中加入碎瓷片,目的是防止暴沸.
(2)为了证明浓硫酸的作用,某同学进行了以下4个实验,实验记录如表:
①为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴酚酞试液,每次实验结束后可观察到试管Ⅱ中的现象是液体分层,上层呈无色,下层呈红色.
②分析实验A、B、C的数据,可以得出浓硫酸在反应中的作用是催化剂、吸水剂;实验D和实验C对照,你又能得出的结论是对该反应起催化作用的实际上为H+.
(3)饱和Na2CO3溶液的作用是中和乙酸、溶解乙醇、降低酯在水中的溶解度,容易分层.
 图是实验室制乙酸乙酯的装置.
图是实验室制乙酸乙酯的装置.(1)加热前,通常需要在试管Ⅰ中加入碎瓷片,目的是防止暴沸.
(2)为了证明浓硫酸的作用,某同学进行了以下4个实验,实验记录如表:
| 实验 编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL3mol•L-1硫酸 | 饱和Na2CO3溶液 | 1.2 |
| D | 3mL乙醇、2mL乙酸、6mL6mol•L-1盐酸 | 饱和Na2CO3溶液 | 1.2 |
②分析实验A、B、C的数据,可以得出浓硫酸在反应中的作用是催化剂、吸水剂;实验D和实验C对照,你又能得出的结论是对该反应起催化作用的实际上为H+.
(3)饱和Na2CO3溶液的作用是中和乙酸、溶解乙醇、降低酯在水中的溶解度,容易分层.
2. 将10mL淀粉胶体和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图所示)2min后,分别取袋内和烧杯内液体进行实验.下列说法正确的是( )
将10mL淀粉胶体和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图所示)2min后,分别取袋内和烧杯内液体进行实验.下列说法正确的是( )
 将10mL淀粉胶体和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图所示)2min后,分别取袋内和烧杯内液体进行实验.下列说法正确的是( )
将10mL淀粉胶体和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图所示)2min后,分别取袋内和烧杯内液体进行实验.下列说法正确的是( )| A. | 烧杯内液体加入硝酸银溶液后有白色沉淀产生 | |
| B. | 烧杯内液体加入碘水后呈蓝色 | |
| C. | 袋内液体加入硝酸银溶液后不会出现白色沉淀 | |
| D. | 袋内液体加入碘水后不变蓝 |
12.下列实验操作中正确的是( )
| A. | 过滤时,不可将悬浊液从烧杯中直接倒入漏斗中 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,现将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| D. | 只要是液体混合物就可以用蒸馏来分离 |
19.某有机物燃烧时,生成等物质的量的CO2和H2O,该有机物还能与新制Cu(OH)2悬浊液反应.则该有机物可能是( )
| A. | CH3CHO | B. | CH2═CHCOOH | C. | CH3CH2OH | D. | CH2═CHCHO |
16.相对分子质量为M的气态化合物vL(标准状况),溶于mg水中,得到质量分数为w的溶液,物质的量浓度为cmol•L-1,密度为ρg•cm-3,则下列说法不正确的是( )
| A. | 相对分子质量M=$\frac{22.4mw}{(1-w)V}$ | B. | 物质的量浓度c=$\frac{1000ρv}{Mv+22.4}$ | ||
| C. | 质量分数w=$\frac{Mv}{22.4m}$ | D. | 溶液密度ρ=$\frac{cM}{1000w}$ |
 中能与上述离子大量共存的
中能与上述离子大量共存的