题目内容
【题目】常温下,pH=10的X、Y两种碱溶液各1mL,分别加水稀释到100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( ) 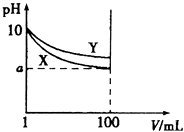
A.稀释前,两种碱溶液中溶质的物质的量浓度一定相等
B.稀释后,X溶液的碱性比Y溶液的碱性强
C.完全中和X、Y溶液时,消耗同浓度盐酸的体积VX>VY
D.若8<a<10,则X、Y都是弱碱
【答案】D
【解析】解:由图象可知,pH=10的碱稀释100倍,X变化大,则Y一定是弱碱,X碱性比Y强,若a=8,则X为强碱, A.Y的碱性弱,pH相同时,Y的浓度大,则稀释前,两种碱溶液中溶质的物质的量浓度不相等,故A错误;
B.稀释后,Y中OH﹣浓度大,X溶液的碱性比Y溶液的碱性弱,故B错误;
C.Y的碱性弱,pH相同时,Y的浓度大,等体积时Y的物质的量大,则完全中和X、Y溶液时,消耗同浓度盐酸的体积VX<VY , 故C错误;
D.a=8,则X为强碱,若8<a<10,则X、Y都是弱碱,故D正确;
故选D.
碱溶液加水稀释,氢氧根离子浓度不断减小,pH不断减小,但弱碱存在电离平衡,加水稀释促进电离,氢氧根离子浓度减小的慢,故pH也减小的慢,所以Y一定是弱碱,X碱性比Y强,若a=8,则X为强碱,以此来解答.

 步步高达标卷系列答案
步步高达标卷系列答案【题目】取一定质量的氯化钠、溴化钠、碘化钠的混合物平均分成五等份,分别加水配成溶液并编号为甲、乙、丙、丁、戊,再分别向各溶液中通入一定体积的氯气,将反应后所得溶液蒸干,灼烧固体。通入氯气的量与最终所得固体质量记录如下:
编号 | 甲 | 乙 | 丙 | 丁 | 戊 |
固体组成 | NaI、NaBr、NaCl | NaBr、NaCl | NaCl | ||
氯气的体积/ml | V | 2V | 3V | 4V | 5V |
固体质量/g | 54.62 | 43.64 | 35.48 | 30.14 | 29.25 |
求:(1)请填写表中空白______________、____________;
(2)标准状况下氯气的体积V为_______,原混合物中溴化钠的物质的量为_______。
【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法错误的是( )
CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法错误的是( )
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2molH2O |
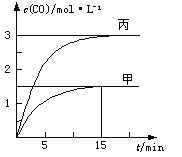
A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1mol·L-1·min-1
B. 丙容器的体积V>0.5 L
C. 当温度为T1℃时,反应的平衡常数K=4.5
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T2< T1