��Ŀ����
���ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼۼ��±���
F��E������������Ӧˮ�������Ӧ��������ˮ�������ϱ����й����ݣ��������ѧ��֪ʶ�����û�ѧ���ﵽ���������⣮
��1��д��DԪ�������ڱ��е�λ�� ��
��2����20��F������������ˮ�����ϡ��Һ������B���⻯���ϡ��Һ��Ӧ�ų�����a kJ����д���÷�Ӧ���Ȼ�ѧ��Ӧ����ʽ ��
��3���õ���ʽ��ʾF2C2���γɹ��� ��
��4��BA2�������ᷴӦ�õ�����ɫ���壬��д����ѧ��Ӧ����ʽ�� ��B��C��F������������Ӧ��ˮ�����γ���Һ��Ũ�Ⱦ�Ϊ0.1mol/Lʱ��pH�ɴ�С��˳��Ϊ ��
��5��1mol F2A2��ˮ��Ӧ���ɵ���Һ��1L 0.5mol/LEB3��Һ��Ӧ�����ӷ���ʽΪ ��
| Ԫ�ش��� | A | B | C | D | E | F |
| ���ϼ� | -2 | -1 | -2��+6 | +4��-4 | +3 | +1 |
| ԭ�Ӱ뾶��nm�� | 0.074 | 0.099 | 0.102 | 0.117 | 0.143 | 0.186 |
��1��д��DԪ�������ڱ��е�λ��
��2����20��F������������ˮ�����ϡ��Һ������B���⻯���ϡ��Һ��Ӧ�ų�����a kJ����д���÷�Ӧ���Ȼ�ѧ��Ӧ����ʽ
��3���õ���ʽ��ʾF2C2���γɹ���
��4��BA2�������ᷴӦ�õ�����ɫ���壬��д����ѧ��Ӧ����ʽ��
��5��1mol F2A2��ˮ��Ӧ���ɵ���Һ��1L 0.5mol/LEB3��Һ��Ӧ�����ӷ���ʽΪ
���㣺λ�ýṹ���ʵ����ϵӦ��
ר�⣺Ԫ����������Ԫ�����ڱ�ר��
�������ڶ�����Ԫ���У�A��C�Ļ��ϼ۶���-2�ۣ�ӦΪ�ڢ�A��Ԫ�أ�C�����Ϊ+6�ۣ�CӦΪSԪ�أ�A�����ۣ�AӦΪOԪ�أ�B��-1�ۣ����ڢ�A�壬ԭ�Ӱ뾶����Oԭ�ӣ���BΪClԪ�أ�D�Ļ��ϼ۶���+4��-4�ۣ�ӦΪ��A��Ԫ�أ�ԭ�Ӱ뾶����Cl����DΪSiԪ�أ�E��+3�ۣ����ڢ�A�壬ԭ�Ӱ뾶����Si����EΪAl��F��+1�ۣ����ڢ�A�壬F��E������������Ӧˮ�������Ӧ��������ˮ����FӦΪNa���ݴ˽��
���
�⣺�ڶ�����Ԫ���У�A��C�Ļ��ϼ۶���-2�ۣ�ӦΪ�ڢ�A��Ԫ�أ�C�����Ϊ+6�ۣ�CӦΪSԪ�أ�A�����ۣ�AӦΪOԪ�أ�D��G�Ļ��ϼ۶���+4��-4�ۣ�ӦΪ��A��Ԫ�أ���D��ԭ�Ӱ뾶�ϴ�DΪSiԪ�ء�GΪ̼Ԫ�أ�B��-1�ۣ����ڢ�A�壬ԭ�Ӱ뾶����̼ԭ�ӣ���BΪClԪ�أ�E��+3�ۣ����ڢ�A�壬ԭ�Ӱ뾶����Si����EΪAl��F��+1�ۣ����ڢ�A�壬F��E������������Ӧˮ�������Ӧ��������ˮ����FӦΪNa��
��1��DΪSiԪ�أ��������ڱ��е������ڢ�A�壬
�ʴ�Ϊ���������ڢ�A�壻
��2��20gNaOH�����ʵ���=
=0.5mol��������ϡ���ᷴӦ�ų�����a kJ����1molNaOH��Ӧ�ų�������Ϊ2a kJ���ʸ÷�Ӧ�Ȼ�ѧ����ʽΪ��HCl��aq��+NaOH��aq���TH2O��l��+NaCl��aq����H=-2akJ/mol��
�ʴ�Ϊ��HCl��aq��+NaOH��aq���TH2O��l��+NaCl��aq����H=-2akJ/mol��
��3���õ���ʽ��ʾNa2S���γɹ���Ϊ��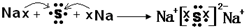 ��
��
�ʴ�Ϊ��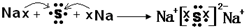 ��
��
��4��ClO2�������ᷴӦ�õ�����ɫ����ΪCl2������Ԫ���غ��֪����˭���ɣ��÷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ��8HC1+2C1O2�T5C12��+4H2O��NaOH��Һ�ʼ��ԣ�HClO4��H2SO4��Һ�����ԣ�����Ϊ��Ԫǿ�ᣬ����Ũ����ͬ����������Ը�ǿ����pH�ɴ�С��˳��ΪNaOH��HClO4��H2SO4��
�ʴ�Ϊ��8HC1+2C1O2�T5C12��+4H2O��NaOH��HClO4��H2SO4��
��5��1molNa2O2��ˮ��Ӧ��������ԭ���غ��֪����NaOHΪ2mol��1L 0.5mol/L AlCl3��Һ��n��Al3+��=1L��0.5mol/L=0.5mol����n��Al3+����n��OH-��=0.5mol��2mol=1��4����Ӧ����ƫ�����ƣ���Ӧ�����ӷ���ʽΪ��Al3++4OH-=AlO2-+2 H2O��
�ʴ�Ϊ��Al3++4OH-=AlO2-+2 H2O��
��1��DΪSiԪ�أ��������ڱ��е������ڢ�A�壬
�ʴ�Ϊ���������ڢ�A�壻
��2��20gNaOH�����ʵ���=
| 20g |
| 40g/mol |
�ʴ�Ϊ��HCl��aq��+NaOH��aq���TH2O��l��+NaCl��aq����H=-2akJ/mol��
��3���õ���ʽ��ʾNa2S���γɹ���Ϊ��
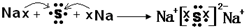 ��
���ʴ�Ϊ��
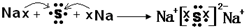 ��
����4��ClO2�������ᷴӦ�õ�����ɫ����ΪCl2������Ԫ���غ��֪����˭���ɣ��÷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ��8HC1+2C1O2�T5C12��+4H2O��NaOH��Һ�ʼ��ԣ�HClO4��H2SO4��Һ�����ԣ�����Ϊ��Ԫǿ�ᣬ����Ũ����ͬ����������Ը�ǿ����pH�ɴ�С��˳��ΪNaOH��HClO4��H2SO4��
�ʴ�Ϊ��8HC1+2C1O2�T5C12��+4H2O��NaOH��HClO4��H2SO4��
��5��1molNa2O2��ˮ��Ӧ��������ԭ���غ��֪����NaOHΪ2mol��1L 0.5mol/L AlCl3��Һ��n��Al3+��=1L��0.5mol/L=0.5mol����n��Al3+����n��OH-��=0.5mol��2mol=1��4����Ӧ����ƫ�����ƣ���Ӧ�����ӷ���ʽΪ��Al3++4OH-=AlO2-+2 H2O��
�ʴ�Ϊ��Al3++4OH-=AlO2-+2 H2O��
���������⿼��λ�ýṹ���ʹ�ϵӦ�ã��Ѷ��еȣ����ݻ��ϼۡ�ԭ�Ӱ뾶ȷ��Ԫ���ǽ���Ĺؼ���ע������Ԫ�������ɣ���5����ע����ݼ���ȷ�����

��ϰ��ϵ�д�
 �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�
�����Ŀ
������������ȷ���ǣ�������
| A��ij��Һ����CCl4��CCl4������ɫ��֤��ԭ��Һ�д���I- |
| B����ij��Һ���ȵμ�CaCl2��Һ��������ɫ�������ٵμ�ϡ��������ܽⲢ������ɫ���壬��������ʹ����ʯ��ˮ����ǣ������Һ��һ����CO32- |
| C��Һ���ӷ������Һ��Ӧ��ˮ�⣬����������ɫ�Լ�ƿ�� |
| D����ij��Һ���ȵμ�BaCl2��Һ��������ɫ�������ٵμ�ϡ�����ɫ�������ܽ⣬����Һһ������SO42- |
��ʵ�����У��������¹ʻ�ҩƷ�Ĵ�����ȷ���ǣ�������
| A���д���������й©ʱ��������������Һ��ʪ�������棬��Ѹ���뿪�ֳ� |
| B���������Ż�ȼ��ʱ������ĭ�������� |
| C������FeSO4��Һʱ��������������м |
| D�������Ľ����ƿ��Ա�����CCl4�� |
���¶Ի�ѧ��Ӧ֪ʶ�Ĺ��ɺ��ܽ��У���ȷ���ǣ�������
| A��������ý�����Ӧһ�������κ����� |
| B�����ܸ�һ�зǽ��������ﷴӦ |
| C�����ʺͻ�����ķ�Ӧһ�����û��� |
| D���û���Ӧ��һ��Ҫ����Һ�н��� |
 ������A��B��C��D��Ϊֻ��C��H��O����Ԫ�صı���һԪ�����������ͼ���漰��7��ת����Ϊ��ѧ��ѧ�г������л���Ӧ����ش�
������A��B��C��D��Ϊֻ��C��H��O����Ԫ�صı���һԪ�����������ͼ���漰��7��ת����Ϊ��ѧ��ѧ�г������л���Ӧ����ش�
 �Լ��飨CH4�����ϳ�����CO��H2����CO2���״���CH3OH������ȩ��HCHO����Ϊ��ʼ��Ӧ����Է�Ӧ�ϳ�һϵ����Ҫ�Ļ���ԭ�Ϻ�ȼ�ϣ�������Ϊ��ʼ��Ӧ��ļ״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
�Լ��飨CH4�����ϳ�����CO��H2����CO2���״���CH3OH������ȩ��HCHO����Ϊ��ʼ��Ӧ����Է�Ӧ�ϳ�һϵ����Ҫ�Ļ���ԭ�Ϻ�ȼ�ϣ�������Ϊ��ʼ��Ӧ��ļ״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����

