题目内容
5.下列化学用语不正确的是( )| A. | 乙酸的键线式为 | B. | 丙烷分子的球棍模型 | ||
| C. | 对氯甲苯的结构简式 | D. | CH4S的结构式 |
分析 A.乙酸中含-COOH,键线表示单键;
B.丙烷分子中含有两个甲基、1个亚甲基,据此判断其球棍模型;
C. 中氯原子和甲基处于间位;
中氯原子和甲基处于间位;
D.用元素符号和短线“-”表示化合物(或单质)分子中原子的排列和结合方式的式子为结构式.
解答 解:A.乙酸中含-COOH,键线表示单键,则键线式为 ,故A正确;
,故A正确;
B.丙烷分子中含有两个甲基和1个亚甲基,碳原子半径大于氢离子,则丙烷的球棍模型为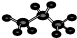 ,故B正确;
,故B正确;
C.对氯甲苯中甲基和氯原子处于对位关系,结构简式为: ,故C错误;
,故C错误;
D.CH4S中存在3个C-H键,1个C-S键,1个S-H键,结构式为 ,故D正确;
,故D正确;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及键线式、球棍模型、结构简式、结构式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
15.在四个相同的容器中,在不同的温度下(其它条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是( )
| A. | v(NH3)=0.1 mol/(L•min) | B. | v (N2)=0.6 mol/(L•min) | ||
| C. | v (N2)=0.02mol/(L•s) | D. | v (H2)=0.3 mol/(L•min) |
16.合成导电高分子材料PPV的反应: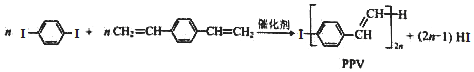
下列说法中正确的是( )
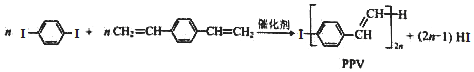
下列说法中正确的是( )
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. | 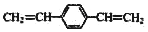 和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 通过质谱法可测定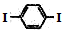 的相对分子质量 的相对分子质量 |
13.含NO3-的工业废水会造成水体富营养化,可用Al将其转化为无毒、无污染的N2,反应的离子方程式为Al+NO3-+?→Al(OH)3+AlO2-+N2↑ (未配平).下列有关说法错误的是( )
| A. | 该反应属于氧化还原反应 | |
| B. | 反应中Al被氧化,NO3-被还原 | |
| C. | ?内的物质可能是H2O | |
| D. | 若有1molAl参加反应,则有1molNO3-被还原 |
20.0.1mol NaCl溶解在多少mol水中,才能使每100个水分子中含有一个Na+离子( )
| A. | 30mol | B. | 100mol | C. | 10mol | D. | 5mol |
10.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
| A. | SiO2$\stackrel{HCl(ap)}{→}$SiCl4$\stackrel{H_{2}}{→}$Si | |
| B. | FeS2$→_{灼烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(aq)}{→}$NH4Cl(aq) | |
| D. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg |
17.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 实验 | 现象 | 结论 | |
| A | 将氯气通入装有湿润的红色布条的集气瓶 | 布条红色褪去 | HClO具有漂白性 |
| B | 将铜粉加入1.0mol•L-1的Fe2(SO4)3溶液中 | 溶液变蓝,有黑色固体出现 | 金属Fe比Cu活泼 |
| C | 用坩埚钳夹住用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点比较低 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水蒸汽在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
2.碘在科研与生活中有重要作用,某兴趣小组用0.20mol•L-1KI、0.4%淀粉溶液、0,20mol•L-1K2S2O8、0.010mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:S2O82-+2I-=2SO42-+I2(慢) I2+2S2O32-=2I-+S4O62- (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O82-):n(S2O32-)>1:2.
(2)如果实验中不使用Na2S2O3溶液,可能存在的不足是显色时间太短,不易测量.
(3)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表:
表中V1=7.5 mL,理由是保证每次实验溶液总体积相等; V2=1 mL,理由是保证淀粉溶液的用量相同.显色时间t1大约是72s.
(4)根据表中数据可以得出的结论是反应速率与反应物浓度成正比关系(反应物浓度越大,反应速率越快).
已知:S2O82-+2I-=2SO42-+I2(慢) I2+2S2O32-=2I-+S4O62- (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O82-):n(S2O32-)>1:2.
(2)如果实验中不使用Na2S2O3溶液,可能存在的不足是显色时间太短,不易测量.
(3)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表:
| 实验 序号 | 试剂体积 V/mL | 显色时间 t/s | ||||
| K2S2O8溶液 | KI溶液 | 水 | Na2S2O3溶液 | 淀粉溶液 | ||
| ① | 10 | 10 | 0 | 4 | 1 | 26.8 |
| ② | 5 | 10 | 5 | 4 | 1 | 54.0 |
| ③ | 2.5 | 10 | V1 | 4 | 1 | 108.2 |
| ④ | 10 | 5 | 5 | 4 | 1 | 53.8 |
| ⑤ | 5 | 7.5 | 7.5 | 4 | V2 | t1 |
(4)根据表中数据可以得出的结论是反应速率与反应物浓度成正比关系(反应物浓度越大,反应速率越快).