题目内容
【题目】下图表示氮及其化合物在一定条件下的转化关系:

(1)反应I:N2(g)+3H2(g)![]() 2NH3(g) ΔH=–92 kJmol-1
2NH3(g) ΔH=–92 kJmol-1
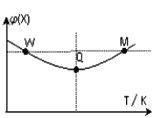
下左图是反应I中平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是________(填“温度”或“压强”)。

(2)①反应II的化学方程式是_________________________。
②反应II其中一步反应为2NH3(g)+3Cl2(g) =N2(g) +6HCl(g) ΔH=–462 kJmol-1
已知:N2(g)![]() 2N(g) Cl2(g)
2N(g) Cl2(g)![]() 2Cl(g)
2Cl(g)
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为________kJ。
(3)(3)反应III是利用右上图所示装置电解制备NCl3(氯的化合价为+1),其原理是:NH4Cl+2HCl![]() NCl3+3H2↑。
NCl3+3H2↑。
①b接电源的_______极(填“正”或“负”)。② 阳极反应式是___________________。
(4)反应III得到的NCl3可以和NaClO2制备 ClO2,同时生成NH3,该反应的离子方程式是________。
【答案】 压强 8NH3+3Cl2=N2+6NH4Cl 41 负 3Cl--6e-+NH4+=NCl3+4H+ NCl3+6ClO2-+3H2O=6ClO2+NH3+3C1-+3OH-
【解析】(1)由图像得出:随着X的增大,氨气的体积分数应该增大。升高温度,平衡向逆反应方向移动,氨气的体积分数应该减小,所以X不可能代表温度。增大压强,平衡向正反应方向移动,氨气的体积分数增大,所以X应该代表压强。
(2)①根据转化关系可以判断,反应物为![]() 和
和![]() ,生成物为
,生成物为![]() 和
和![]() ,然后根据得失电子守恒和原子守恒配平,化学方程式为
,然后根据得失电子守恒和原子守恒配平,化学方程式为![]() 。
。
②化学反应的过程是旧化学键断裂(吸收能量)和新化学键形成(放出能量)的过程,设断开1 mol H–N键吸收a kJ能量,断开1 mol H–Cl键吸收b kJ能量,根据化学反应2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH=–462 kJmol-1,得到6×a+3×243-945-6×b=-462,得![]() ,所以断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为41kJ。
,所以断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为41kJ。
(3)①b电极的反应为H+得电子生成氢气,发生还原反应,所以b电极为阴极,连接电源的负极。
②阳极反应物为NH4Cl,生成物为NCl3 ,题目中给出氯的化合价为+1价,所以氯失去电子,化合价升高,氮、氢不变价,然后根据电荷守恒配平方程式,则阳极反应式是![]()
(4)根据题意,![]() 可以和
可以和![]() 制备
制备![]() ,同时生成
,同时生成![]() ,反应物为
,反应物为![]() ,生成物为
,生成物为![]() ,根据化合价升降相等、电荷守恒和原子守恒配平,该反应的离子方程式是NCl3+6ClO2-+3H2O=6ClO2+NH3↑+3C1-+3OH- 。
,根据化合价升降相等、电荷守恒和原子守恒配平,该反应的离子方程式是NCl3+6ClO2-+3H2O=6ClO2+NH3↑+3C1-+3OH- 。