��Ŀ����
��X��Y��Z��W���ֶ�����Ԫ�أ�ԭ����������������˵�����ܺ�Ϊ38��YԪ��ԭ������������ռ�����ܵ�������3/4��WԪ��ԭ���������ӱ�ͬ����ZԪ�ض�5�����ӣ�W��Y����ͬһ���壮
(1)д��Ԫ�ط��ţ�X________��Y________��Z________��W________��
(2)Z��W��Ԫ������������Ӧˮ���ﷴӦ�ķ���ʽ��________��
(3)��Z�ĵ���(Ƭ״)������з�̪�ķ�ˮ�У��۲쵽��������________����Ӧ�Ļ�ѧ����ʽ��________��
�𰸣�
������
������
|
����(1)H,O,Mg,Cl ����(2)Mg(OH)2��2HClO4��Mg(ClO4)2��2H2O ����(3)�������ݷ�̪��� ����Mg��2H2O |

��ϰ��ϵ�д�
�����Ŀ

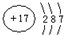

 ��X��Y��Z��W���ֶ�����Ԫ�أ�ԭ��������������X�������Ӿ���һ�����ӣ�Z��W�����ڱ��ڴ���ͬһ��������λ�ã����ǵĵ�����ͨ��״���¾�Ϊ��ɫ���壮Yԭ�ӵ������������Ǵ�����������2������ش�
��X��Y��Z��W���ֶ�����Ԫ�أ�ԭ��������������X�������Ӿ���һ�����ӣ�Z��W�����ڱ��ڴ���ͬһ��������λ�ã����ǵĵ�����ͨ��״���¾�Ϊ��ɫ���壮Yԭ�ӵ������������Ǵ�����������2������ش�