题目内容
【题目】
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1) 基态Ni原子核外电子排布式为________;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________ 。
(2) 金属Ni粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。试推断Ni(CO)4的晶体类型为_____,Ni(CO)4 易 溶于下列_____ (填选项字母) 中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(3) FeO、NiO 晶体中r(Ni2+)和r(Fe2+)分别为69pm 和78pm,则熔点NiO__FeO(填“>"或“<”),原因为_________ 。
(4) 黄血盐是一种配合物,其化学式为K4[Fe(CN)6]·3H2O,该配合物中配体的化学式为_________,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_________ 。
(5) 酸性K2Cr2O7能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20℃水中的溶解度之比为0.39,其原因为________。
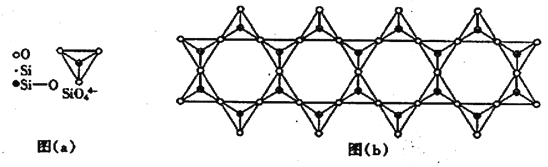
(6) 在铬的硅酸盐中,SiO44-四面体如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中硅原子的杂化形式为_______,其化学式为________。
【答案】 1s22s22p63s23p63d84s2 氧 分子晶体 BC > r(Ni2+)<r(Fe2+),NiO的晶格能大于FeO CN- K4[Fe(CN)6]·3H2O+6H2SO4+3H2O![]() 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑ 邻硝基苯酚形成分子内氢键,降低其在水中的溶解度;对硝基苯酚与水形成分子间氢键,增大了溶解度。 sp3 (Si4O11)n6n-或Si4O116-
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑ 邻硝基苯酚形成分子内氢键,降低其在水中的溶解度;对硝基苯酚与水形成分子间氢键,增大了溶解度。 sp3 (Si4O11)n6n-或Si4O116-
【解析】(1)Ni是28号元素,核外有28个电子,分四层排布,其电子排布式为:1s22s22p63s23p63d84s2或[Ar]3d84s2;Ni有2个未成对电子,第二周期元素未成对电子数为2的元素有C、O,其中电负性大的是O,故答案为:1s22s22p63s23p63d84s2;氧;
(2)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,应为分子晶体,呈正四面体构型,应为非极性分子,易溶于非极性溶剂,故选BC,故答案为:分子晶体;BC;
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,晶格能越大,熔点越高,由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,故答案为:>; r(Ni2+)<r(Fe2+),NiO的晶格能大于FeO;
(4)K4[Fe(CN)6]3H2O中CN-为配体;K4[Fe(CN)6].3H2O与硫酸在加热条件下反应生成K2SO4、CO、FeSO4、(NH4)2SO4,则其反应方程式为:K4[Fe(CN)6]·3H2O+6H2SO4+3H2O![]() 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑,故答案为:CN-;K4[Fe(CN)6].3H2O+6H2SO4+3H2O
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑,故答案为:CN-;K4[Fe(CN)6].3H2O+6H2SO4+3H2O![]() 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑;
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑;
(5)形成分子间氢键能增大物质的溶解性,形成分子内氢键,减小物质的溶解性,邻硝基苯酚形成分子内氢键,降低其在水中的溶解度,对硝基苯酚与水形成分子间氢键,增大了溶解度;故答案为:邻硝基苯酚形成分子内氢键,降低其在水中的溶解度;对硝基苯酚与水形成分子间氢键,增大了溶解度;
(6)硅酸盐中的硅酸根(SiO44-)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;根据图(b)可知一个重复的结构单元为:![]() ,其中含有硅原子数为2+4×
,其中含有硅原子数为2+4×![]() =4,氧原子数为8+6×
=4,氧原子数为8+6×![]() =11,根据正负化合价的代数和为电荷数可知,该离子带6个单位的负电荷,离子符号为Si4O116-,故答案为:sp3;Si4O116-。
=11,根据正负化合价的代数和为电荷数可知,该离子带6个单位的负电荷,离子符号为Si4O116-,故答案为:sp3;Si4O116-。

【题目】氮元素可形成多种化合物,在工业生产中具有重要价值。 请回答下列问题:
(1)已知拆开1mol H-H 键,1mol N-H键, 1mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,且该反应为可逆反应,则N2与H2反应合成NH3的热化学方程式为_________。
(2)一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行合成氨反应,
①下列描述能说明该可逆反应达到化学平衡状态的有___________
A.容器内气体的密度不变 B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C.容器内的压强不变 D.3v正(H2) =2v逆(NH3)
E. 容器内气体的平均相对分子质量不变
F. 相同时间内有3molH-H键断裂,有6mol N-H键形成
②恒温恒压条件下,为提高合成氨反应中N2和H2的利用率,可以采用的方法有________________。
(3)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g)![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①20s内,v(NO2)=___________,该温度下反应的化学平衡常数数值为_________。
②升高温度时,气体颜色加深,则正反应是_________(填“放热”或“吸热”)反应。
③相同温度下,若开始向该容器中充入0.40 mol NO2,则达到平衡后: c(NO2)_____0.15 mol·L-1(填“>”、 “=”或“<”)