题目内容
(8分)A、B、C、D、E、F为原子序数依次增大的六种元素。已知:A是周期表中原子半径最小的元素,B的基态原子核外电子有7种运动状态,B、C、E三种元素原子中未成对电子数之比为3:2:l,D原子核外有4个能级且均充满电子,D与E可形成DE2型化合物,F原子核外最外层只有1个电子,其余各层均充满电子。回答下列问题:
(1)写出下列元素的名称:B______ C_____ E_______
(2)F在元素周朔表的位置是_________,与F同周期且未成对电子数最多的元素为______(填写元素符号),该元素基态原子的核外电子电子排布式为__________;
(3)B与D组成的化合物可以与水反应,写出它与水反应的化学方程式______________。
(1)氮 氧 氯
(2)第4周期第ⅠB族 Cr 1s22s22p63s23p63d54s1(每空1分)
(3)Mg3N2+6H2O=3Mg(OH)2+2NH3↑(2分)
解析试题分析:根据题意知,A、B、C、D、E、F为原子序数依次增大的六种元素。A是周期表中原子半径最小的元素,则A为氢元素;B的基态原子核外电子有7种运动状态,B原子核外电子数为7,则B为氮元素;D原子核外有4个能级且均充满电子,核外电子排布式为1s22s22p63s2,则D为Mg元素;B、C、E三种元素原子中未成对电子数之比为3:2:1,则C、E的原子中未成对电子数分别为2、1,C的原子序数介于氮、镁元素之间,则C原子核外电子排布式为1s22s22p4,C为氧元素;F原子核外最外层只有1个电子,其余各层均充满电子,原子序数大于镁元素,则F原子各层电子数为2、8、18、1,则F为铜元素,E的原子序数大于镁,D与E可形成DE2型化合物,则E为-1价,则E为Cl元素。(1) B为氮,C为氧,E为氯;(2)F为铜元素,在元素周期表的位置是第4周期第ⅠB族,与铜同周期且未成对电子数最多的元素为Cr ,该元素基态原子的核外电子电子排布式为1s22s22p63s23p63d54s1;(3)氮与镁组成的化合物氮化镁与水反应生成氢氧化镁沉淀和氨气,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑。
考点:考查元素推断及相关物质的性质。

 阅读快车系列答案
阅读快车系列答案元素周期表是学习物质结构和性质的重要工具。请参照元素①-⑦在周期表中的位置,回答下列问题:
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | | | |
(1)元素⑦在元素周期表的位置为______________,
(2)由原子个数比为1:1:1的①、②、③ 三种元素组成共价化合物X,共形成4对共用电子对,X的结构式为 。
(3)⑥的最高价氧化物与⑤的最高价氧化物对应的水化物在溶液中进行的的离子反应方程式__________________________________。
(4)由表中两种元素的原子按1:1组成的离子化合物常用作供氧剂,该化合物中的化学键类型为_____________________。
(5)A、B、D、E是由上述部分元素组成的化合物,它们之间的转化关系如图所示(部分产物已略去)。A、B、D的焰色反应均呈黄色,水溶液均为碱性。请回答:

①E的电子式为 。
②自然界中存在B、D和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至质量不再发生变化,剩余固体的质量为 g。
(12分)【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
下表为元素周期表的一部分,其中的字母代表相应的元素。
| a | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | b | c | d | | |
| | e | | | | | | | | | | | f | | g | | | |
| | | | | | | | | h | I | | | | | | | | |
(2)元素c、d、e、f的第一电离能(I1)由小到大的顺序为 。(用相应元素的元素符号表示)
(3)表中所列的元素之间可以形成多种无机化合物和有机化合物,则它们形成的化合物之一——邻甲基苯甲醛的分子中碳原子轨道的杂化类型为 。
1 mol 苯甲醛分子中含有σ键的数目为 。
(4)元素d与e形成的化合物常用于制作 材料,其原因是 。
(5)表中有关元素形成的一种离子和单质d3互为等电子体,则该离子的化学式为 。
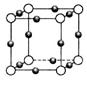
(6)元素I的合金可用来储存a的单质,该合金的晶胞结构如图所示,则此合金的化学式为 。
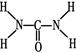 ,则尿素分子中C和N原子的杂化方式分别是、。
,则尿素分子中C和N原子的杂化方式分别是、。



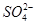 的空间构型为_________,H2O中O原子的杂化方式为____________。
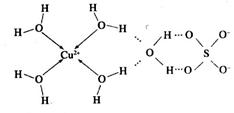
的空间构型为_________,H2O中O原子的杂化方式为____________。 配离子。已知
配离子。已知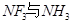 的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
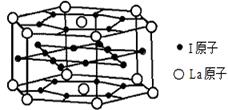
的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。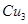 N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。
N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。