��Ŀ����
����Ŀ����д���пհף�
(1)д����ʾ����8�����ӡ�10�����ӵ�ԭ�ӵĻ�ѧ���ţ�________��
(2)���ڱ���λ�ڵ�8���е���Ԫ�����ڵ�________�塣
(3)���м������ʣ���Ca(OH)2��H2O2��He��H2S ��MgCl2 ,ֻ�������Ӽ�����(ѡ����ţ���ͬ)_________��ֻ���м��Թ��ۼ��Ļ�������________��
(4)HClO�Ľṹʽ______��I2�ĵ���ʽ______��
(5)���б仯�У��ٸɱ���������������ۻ�����KHSO4���ڣ���������Һˮ����������ˮ��δ�ƻ���ѧ������ _____��
(6)���в���˵����Ԫ��ԭ�ӵõ�����������Ԫ��ԭ�ӵõ�������ǿ����_____________
��HCl���ܽ�ȱ�H2S�Ĵ� ��HCl�����Ա�H2S��ǿ ��HCl���ȶ��Ա�H2S��ǿ��Cl2������Ӧ����FeCl3����S������Ӧ����FeS ��HClO4�����Ա�H2SO4��ǿ ��Cl2����H2S��Ӧ����S
���𰸡�![]() �� �� �� H-O-Cl
�� �� �� H-O-Cl ![]() �٢� �٢�
�٢� �٢�
��������
������������������д����ԭ�ӵĻ�ѧ���ţ������������ڱ���λ�ûش𣻸������ʵ����ش�ѧ�������ͣ����ݴ����ᡢ�ⵥ�ʵĽṹд���ṹʽ�͵���ʽ����������������ѧ���������лش𣻸���Ԫ�صķǽ�����Խǿ���õ�������Խǿ�����жϡ�
(1)����8�����ӡ�10�����ӵ�ԭ������ԭ�ӣ�Ԫ�ط������½DZ�ע�����������ϽDZ��������������������������+������=8+10=18����ѧ���ű�ʾΪ��![]() ��
��
(2)����26��Ԫ�أ������ڱ���λ�ڵ�8���е���Ԫ�����ڵ����壻
(3)��Ca(OH)2�����ӻ���������Ӻ����������Ӽ��γ����ӽ�����ԭ�Ӻ���ԭ��֮���γɼ��Թ��ۼ����������ӽ��ֺ����Թ��ۼ���
��H2O2���ڹ��ۻ�����������Թ��ۼ����ֺ��Ǽ��Թ��ۼ���
��He��ϡ�����壬������ѧ����
��H2S���ڹ��ۻ���� ��ֻ�����Թ��ۼ���
��MgCl2��ֻ�����Ӽ���
ֻ�������Ӽ����Ǣݣ�ֻ���м��Թ��ۼ��Ļ������Ǣܣ�
(4)HClO����ԭ���γ����Թ��õ��Ӷԣ��ṹʽH-O-Cl����ԭ�Ӽ��γ�һ�Թ��õ��Ӷԣ�I2�ĵ���ʽ![]() ��
��
(5)�ٸɱ��������ƻ����Ƿ��Ӽ���������
��������ۻ����ƻ��������Ӽ���
�� KHSO4���ڣ��ƻ��������Ӽ���
��������Һˮ���ƻ����Ƿ��Ӽ���������
����������ˮ���ƻ����ǹ��ۼ���
δ�ƻ���ѧ�����Ǣ٢ܣ�
(6)��HCl���ܽ�ȱ�H2S�Ĵ��ܽ������ʧ�����أ�����˵����Ԫ��ԭ�ӵõ�����������Ԫ��ԭ�ӵõ�������ǿ��
��HCl�����Ա�H2S��ǿ��˵������������ӵ�����HCl��H2S�����ʧ�����أ�����˵����Ԫ��ԭ�ӵõ�����������Ԫ��ԭ�ӵõ�������ǿ��
��HCl���ȶ��Ա�H2S��ǿ��˵���ǽ�����Cl��S����˵����Ԫ��ԭ�ӵõ�����������Ԫ��ԭ�ӵõ�������ǿ��
��Cl2������Ӧ����FeCl3����S������Ӧ����FeS��˵�������������Դ�������Ԫ�صķǽ����Դ�������˵����Ԫ��ԭ�ӵõ�����������Ԫ��ԭ�ӵõ�������ǿ��
��HClO4�����Ա�H2SO4��ǿ����Ԫ�صķǽ����Դ�������˵����Ԫ��ԭ�ӵõ�����������Ԫ��ԭ�ӵõ�������ǿ��
��Cl2����H2S��Ӧ����S��˵�������������Դ�������Ԫ�صķǽ����Դ�������˵����Ԫ��ԭ�ӵõ�����������Ԫ��ԭ�ӵõ�������ǿ��
����˵����Ԫ��ԭ�ӵõ�����������Ԫ��ԭ�ӵõ�������ǿ���Ǣ٢ڡ�

����Ŀ����ѧ��Ӧ���ʺ���������������������ء�
(1)ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯����400mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼����(�ۼ�ֵ)��
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
���������mL������״���� | 100 | 240 | 464 | 576 | 620 |
����һʱ��η�Ӧ�������__min(��0��1��1��2��2��3��3��4��4��5)��ԭ����___��
����3��4����ʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����___(����Һ�������)��
(2)��һѧ��Ϊ���Ʒ�Ӧ���ʷ�ֹ��Ӧ�������Բ�������������������������м���������������Һ�Լ�����Ӧ���ʣ�����Ϊ�����е���___��
A.����ˮ B.KCl��ҺC.KNO3��ҺD.CuSO4��Һ
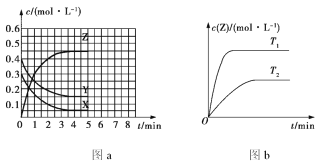
(3)ij�¶�����4L�ܱ������У�X��Y��Z������̬���ʵ����ʵ�����ʱ��仯������ͼ��

�ٸ÷�Ӧ�Ļ�ѧ����ʽ��___��
�ڸ÷�Ӧ�ﵽƽ��״̬�ı�־��___��
A.Y����������ڻ�������б��ֲ���
B.2v(X)=3v(Z)
C.����������ѹǿ���ֲ���
D.X��Y��Z���������Ũ��֮��Ϊ3:1:2
E.����1molY��ͬʱ����2molZ
F.�����������ƽ����Է����������ֲ���
��2min��Y��ת����Ϊ___��
����Ŀ��ij�¶����ڼס��ҡ������������ܱ������У�Ͷ��H2(g)��CO2(g)������H2(g)+CO2(g)CO(g)+H2O(g)������ʼŨ�������ʾ����֪��ƽ��ʱ����CO�����Ũ��Ϊ0.006mol/L�������жϲ���ȷ���ǣ� ��
��ʼŨ��(mol/L) | �� | �� | �� |
c(H2) | 0.010 | 0.020 | 0.020 |
c(CO2) | 0.010 | 0.010 | 0.020 |
A.��Ӧ��ʼʱ�����еķ�Ӧ������죬���еķ�Ӧ��������
B.ƽ��ʱ���ס��ҡ�����CO2��ת���������¹�ϵ����>��=��=60%
C.ƽ��ʱ������c(CO2)�Ǽ��е�2������0.012mol/L
D.�ı�����ʹ�����¶Ƚ��ͣ���ƽ����H2��Ũ������������Ӧ����H>0
����Ŀ����0.4mol N2�����1mol H2������2L�̶��������ڻ�ϣ���һ�������·�����Ӧ��N2(g)+3H2(g)2NH3(g)����2min����NH3��Ũ��Ϊ0.2molL-1��
(1)2minʱH2��ת����Ϊ______��
(2)2minʱ�������������Ϊ_____mol��
(3)��ͬ�¶��£���2min��÷�Ӧ��ƽ�⣬��Ӧǰ�������ѹǿ��Ϊ___ ��
(4)���д�ʩ������Ӧ���ʵ���___(����ĸ)��
A�����º��ݳ���He�� B����С�����ʹѹǿ����
C�����º�ѹ����He�� D��ʹ�ô���
(5)�ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ƿ�Ӧ��Ļ�ѧ�����ƻ���������Ļ�ѧ�����γɹ��̡���֪��1molN2��3molH2��Ӧ����2molNH3ʱ�ų�����93kJ��
��ѧ�� | H-H | N-H | N��N |
����kJ/rmol | 436 | a | 945 |
�Ը��ݱ������м������ݼ���a����ֵ______��