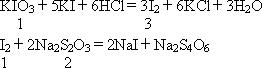题目内容
下表是某地市场销售的一种加碘食盐包装袋上的部分文字说明:

某研究小组对该碘盐进行了分析:称取40.0 g碘盐配成100 mL溶液,取20.00 mL该溶液于锥型瓶中,向锥型瓶中加入足量碘化钾溶液,并加入几滴淀粉溶液,混合均匀后,用0.001 mol/L Na2S2O3溶液进行滴定.滴定前滴定管的液面读数为0.22 mL,滴定达终点时滴定管的液面读数为15.22 mL.
(KIO3+5KI+6HCl 3I2+6KCl+3H2O,I2+2Na2S2O3
3I2+6KCl+3H2O,I2+2Na2S2O3 2NaI+Na2S4O6)
2NaI+Na2S4O6)
(1)通过计算判断该碘盐的含碘量是否在20~40 mg/kg的范围内?
(2)若成年人每天需摄入0.15~0.20 mg碘才能满足人体健康的需要.假设一个成人除了从加碘盐中获取碘元素外,不再通过其他途径获取碘元素,通过计算说明成人平均每天食用5 g加碘盐是否能获得所需要的碘?
解析:
|
(1)反应的化学方程式为: 所以KIO3∶Na2S2O3=1∶6 消耗Na2S2O3的物质的量=(15.22 mL-0.22 mL)÷1000×0.001 mol/L=0.000015 mol KIO3的物质的量=0.000015 mol÷6=0.0000025 mol(3分) I的质量=0.0000025 mol×127=0.0003175 g=0.3175 mg(2分) 含碘量=100 mL÷20.00 mL×0.3175 mg÷0.04 kg=39.6875 mg/kg(3分) (2)5 g÷1000×39.6875 mg/kg=0.1985 mg 能(4分) |

(9分)下表是某地市场销售的一种“加碘食盐”包装袋上的部分文字说明。
|
配 料 |
氯化钠、碘酸钾 |
|
含碘量 |
(20mg~40mg)/1kg |
|
保质期 |
18个月 |
|
食用方法 |
勿长时间炖炒 |
|
贮藏指南 |
避热、防潮 |
(1)已知碘在碘酸钾中的化合价为+5,1mol碘酸钾中共含5mol原子,则碘酸钾的化学式为____________________________________________________。
(2)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式:
_________+_________KI+_________H2SO4—_________K2SO4+_________I2+_________H2O
(3)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。某学生设计回收四氯化碳的操作步骤为:
a. 将碘的四氯化碳溶液置于分液漏斗中;
b. 加入适量Na2SO3稀溶液;
c. 分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是__________________________。
(4)由食用方法和贮藏指南可推测碘酸钾的化学性质之一是_____________。
(5)用单质碘与氯酸钾发生置换反应可制得碘酸钾,该反应的化学方程式为_____________。