题目内容
10.CuCl2、CuCl是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如图1:
请回答下列问题:
(1)如图2装置进行反应①,导管a通入氯气(夹持仪器和加热装置省略).观察到的现象是试管内有棕色烟产生,写出铜与氯气反应的化学方程式Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$CuCl2.
(2)上述流程中固体K溶于稀盐酸的目的是避免Cu2+水解.试剂X、固体J的物质分别为c.
a.NaOH Fe(OH)3 b.NH3•H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+.
(4)反应后,如图盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效.该红褐色沉淀的主要化学式是Fe(OH)3.该腐蚀过程的正极反应式为ClO-+2e-+H2O=Cl-+2OH-.
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式Cu2++e-+Cl-=CuCl.
分析 粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,同时抑制氯化铜、氯化铁水解,溶液1中加入X调节溶液pH,得到溶液乙,经过系列操作得到CuCl2•2H2O,故溶液2为CuCl2溶液,则调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,试剂X可以为CuO、氢氧化铜等,结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却结晶得到CuCl2•2H2O,再经过过滤、洗涤、干燥得到纯净的晶体.
(1)铜在氯气中燃烧产生棕色氯化铜烟;
(2)氯化铜、氯化铁在溶液中会发生水解,铜盐水解生成氢氧化铜,保持溶液呈强酸性,避免铜离子水解损失,调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀;
(3)铜离子是氧化剂,SO2是还原剂,生成CuCl和SO42-;
(4)氢氧化钠溶液吸收氯气,生成有次氯酸钠,生铁在次氯酸钠和氢氧化钠的混合溶液中发生电化学腐蚀,碳等杂质为正极,铁为负极,正极发生还原反应,负极发生氧化反应,红褐色沉淀为氢氧化铁,正极上ClO-得电子生成Cl-;
(5)Cu2+在阴极上得电子,铜元素的化合价可以降至+1价、0价,部分CuCl析出是Cu2+得到电子生成CuCl,结合电荷守恒配平书写电极反应.
解答 解:(1)铜在氯气中燃烧生成固体氯化铜,观察到棕黄色的烟,反应为:Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$CuCl2,
故答案为:试管内有棕色烟产生;Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$CuCl2;
(2)氯化铜、氯化铁中的金属离子易水解,直接用水溶液配制溶液会产生浑浊,所以加入过量的盐酸来溶解氯化铜、氯化铁,以抑制氯化铜、氯化铁水解;用于调节pH以除去溶液1杂质可加试剂具有与酸反应,且不引入Cu2+之外的离子,故用CuO或Cu2(OH)或Cu2(OH)2CO3,调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,且不能引入新杂质,
故答案为:避免Cu2+水解;c;
(3)根据信息可知:在加热条件下,SO2与铜离子反应生成CuCl白色沉淀和SO42-,其反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-,
故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+;
(4)氢氧化钠溶液吸收氯气,生成有次氯酸钠,生铁在次氯酸钠和氢氧化钠的混合溶液中发生电化学腐蚀,碳等杂质为正极,铁为负极.负极的电极反应式为Fe-2e-=Fe2+,Fe2++2OH-=Fe(OH)2,4Fe(OH)2+O2+2H2O=4Fe(OH)3,正极的电极反应式为ClO-+2e-+H2O=Cl-+2OH-,红褐色沉淀为氢氧化铁,
故答案为:Fe(OH)3;ClO-+2e-+H2O=Cl-+2OH-;
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,阴极上是得到电子发生还原反应,Cu2+得到电子生成CuCl,电极反应为:Cu2++e-+Cl-=CuCl,
故答案为:Cu2++e-+Cl-=CuCl.
点评 本题以实验室制备氯化铜为背景,考查了物质的制备实验操作、离子检验、除杂质、离子方程式的书写、原电池原理的应用等,题目涉及的知识点较多,侧重于基础知识的综合应用的考查,题目难度中等.

Ⅰ.Cu(NO3)2 的氧化性
将光亮的铁丝伸入Cu(NO3)2 溶液中,一段时间后将铁丝取出.为检验溶液中Fe 的氧化产物,将
溶液中的Cu2+除尽后,进行了如下实验.可选用的试剂KSCN 溶液、K3[Fe(CN)6]溶液、氯水.
(1)请完成下表:
| 操作 | 反应或现象 | 结论 |
| 取少量除尽Cu2+后的溶液于试管中,加入①溶液,振荡 | 显性② | 存在Fe3+ |
| 取少量除尽Cu2+后的溶液于试管中,加入K3[Fe(CN)6]溶液,振荡 | 离子方程式③ | 存在Fe2+ |
在如图1所示的实验装置A 中,用酒精喷灯对Cu(NO3)2 固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为O2.当反应结束以后,试管中残留固体为红色.

(2)装置B 的作用是除去混合气体中的NO2.
(3)从实验安全角度考虑,需要在A、B 间加入装置M,请在方框中如图2出M 装置
(4)如图3为Cu(NO3)2 样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线).Cu(NO3)2
加热到200℃的化学方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$ 2CuO+4NO2↑+O2↑,继续高温至1000℃生成Cu2O(填化学式)固体.
| A. | 亚硝酸钠是常用的防腐剂 | |
| B. | 婴儿食品可添加着色剂,以增加婴儿对食物的兴趣 | |
| C. | 食用盐既可以做防腐剂,又可以做调味剂 | |
| D. | 药物可以帮助我们战胜疾病,但我们仍需合理用药 |
a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究,实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是控制分液漏斗的活塞,使浓硫酸缓慢滴入A中.
(4)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是A中反应一会生成二氧化硫,C中才能反应.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(5)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. ④向滤液滴加2滴淀粉溶液,再逐滴加0.100 0mol•L-1碘的标准溶液,至溶液呈紫色不再褪去,消耗碘的标准溶液体积为18.10mL. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2S、Na2CO3, 一定不含有Na2SO4. 操作④发生的反应是: 2S2O${\;}_{3}^{2-}$+I2═S4O${\;}_{6}^{2-}$+2I- 产品纯度:$\frac{9}{w}$×100%. |
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液.
| A. | ④⑤①②③ | B. | ④⑤①③② | C. | ⑤①③②④ | D. | ④③①⑤② |
 .
.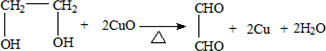 .
. .
.
 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.

 ;
;