题目内容
【题目】氨对地球上的生物相当重要,它是许多食物和肥料的重要成分。氨也是制造硝酸、化肥、炸药 的重要原料。氨在国民经济中占有重要地位。回答下列问题:
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是_______________。
②若起始时向容器内放入1 mol N2和3 mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为____________;若在同体积的容器中充人2 mol N2和6 molH2,达平衡后放出的热量为Q2 kJ,则Q2__________(填“>”、“<”或“=”)2Q1。
③已知:

1 mol N-H键断裂吸收的能量约等于__________kJ。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2 (g)+3H2 (g)![]() 2NH3 (g),其平衡常数K与温度T的关系如下表:
2NH3 (g),其平衡常数K与温度T的关系如下表:
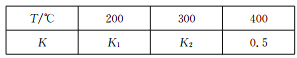
①平衡常数表达式K=_________,K1___________(填“>”、“<”或“一”)K2。
②一定温度下,下列各项能作为判断该反应达到化学平衡状态的依据是__________(填字母)。
a.容器内N2、H2、NH3的浓度之比为1: 3:2
b.浓度商Q=平衡常数K
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2 mol、1 mol、2 mol时,则此时该反应_________(填“处于”或“不处于”)平衡状态。
【答案】(1)①N2(g)+3H2(g)![]() 2NH3(g)△H=-92.2kJ·mol-l
2NH3(g)△H=-92.2kJ·mol-l
②18.44(2分);>(1分)③391(3分)
(2)①![]() (2分);>②bc(2分)③处于
(2分);>②bc(2分)③处于
【解析】
试题分析:成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。根据反应规律:氨的热化学方程式是:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.2kJ·mol-l;
2NH3(g) △H=-92.2kJ·mol-l;
②N2(g)+3H2(g)![]() 2NH3(g) △H=-92.2kJ·mol-l;
2NH3(g) △H=-92.2kJ·mol-l;
起始 1 mol 3 mol 0
变化 1×20% 3×20% 2×20%
根据反应规律:1molN2----92.2kJ;0.2molN2放热18.44kJ;若在同体积的容器中充人2molN2和6molH2,比原来都加倍,相当于加压平衡右移,放出热量的数值Q2》2Q1。
③ 断裂1摩尔氮氮三键吸收热量945。8 kJ,断裂3摩尔氢氢键吸收热量kJ;该反应N2 (g)+ 3 H2 (g)![]() 2NH3 (g) △H = - 92.2 kJ·mol-l,945.8+3×436-2×3×Q=-- 92.2;解之得出Q=391 kJ
2NH3 (g) △H = - 92.2 kJ·mol-l,945.8+3×436-2×3×Q=-- 92.2;解之得出Q=391 kJ
④平衡常数表达式为生成物浓度的幂之积与反应物浓度的幂之积的比值,K=![]() ;
;
⑤化学平衡状态的依据为
a.容器内N2、H2、NH3的浓度之比为1: 3:2,与平衡与否无关
b.浓度商Q=平衡常数K。达到平衡状态;
c.反应前后体积变化不为零,反应后压强变小,因此容器内压强保持不变,达平衡状态;
d.混合气体的密度等于m/v, 反应前后都为气体,m混不变,固定体积,v不变,反应是否平衡,
混合气体的密度保持不变;

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案