题目内容
(1)下列方法中,能证明HA是弱酸的是
A.测得0.1mol/L的HA溶液的pH>1
B.pH=2的HA溶液和pH=12的NaOH溶液等体积混合,测混合后溶液的pH<7
C.HA与Na2CO3溶液反应生成CO2
D.向HA溶液中加一定量的NaOH溶液到恰好呈中性,溶液中c(Na+)=c(A-)
E.pH相同的盐酸和HA溶液,与Zn反应产生等体积氢气时HA溶液所需时间较短
请另外设计方案证明HA是弱酸:
(2)NaClO溶液显
ABE
ABE
;A.测得0.1mol/L的HA溶液的pH>1
B.pH=2的HA溶液和pH=12的NaOH溶液等体积混合,测混合后溶液的pH<7
C.HA与Na2CO3溶液反应生成CO2
D.向HA溶液中加一定量的NaOH溶液到恰好呈中性,溶液中c(Na+)=c(A-)
E.pH相同的盐酸和HA溶液,与Zn反应产生等体积氢气时HA溶液所需时间较短
请另外设计方案证明HA是弱酸:
将pH=1的HA溶液1mL稀释至100mL,其pH<3(或用pH试纸测得NaA溶液的pH>7)
将pH=1的HA溶液1mL稀释至100mL,其pH<3(或用pH试纸测得NaA溶液的pH>7)
.(2)NaClO溶液显
碱性
碱性
性,其原因是ClO-水解使溶液显碱性:ClO-+H2O?HClO+OH-
ClO-水解使溶液显碱性:ClO-+H2O?HClO+OH-
;在NaClO溶液含有的粒子有Na+、ClO-、H+、OH-、HClO、H2O
Na+、ClO-、H+、OH-、HClO、H2O
.分析:(1)根据弱酸属于弱电解质,溶液中部分电离出氢离子,弱酸根离子在溶液中能够发生水解,强碱弱酸盐水解显示碱性等进行判断;也可以通过溶液的稀释,根据溶液pH变化判断HA属于弱酸;
(2)次氯酸钠属于强碱弱酸盐,次氯酸根离子水解显示碱性,根据次氯酸钠水解方程式判断NaClO溶液含有的粒子.
(2)次氯酸钠属于强碱弱酸盐,次氯酸根离子水解显示碱性,根据次氯酸钠水解方程式判断NaClO溶液含有的粒子.
解答:解:(1)A.测得0.1mol/L的HA溶液的pH>1,说明溶液中氢离子浓度小于0.1mol/L,HA在溶液中部分电离出氢离子,HA属于弱酸,故A正确;
B.pH=2的HA溶液和pH=12的NaOH溶液等体积混合,测混合后溶液的pH<7,说明混合后溶液显示酸性,证明了pH=2的HA溶液中,HA浓度大于0.01mol/L,HA部分电离,属于弱酸,故B正确;
C.HA与Na2CO3溶液反应生成CO2,只能说明酸性HA的大于碳酸的酸性,不能判断HA是否属于弱酸,故C错误;
D.向HA溶液中加一定量的NaOH溶液到恰好呈中性,溶液中c(Na+)=c(A-),属于酸碱中和反应,不能判断HA是否属于弱酸,故D错误;
E.pH相同的盐酸和HA溶液,与Zn反应产生等体积氢气时HA溶液所需时间较短,说明反应过程中,HA能够电离出氢离子,证明了HA在原溶液中部分电离,所以HA属于弱酸,故E正确;
可以通过稀释AH溶液,根据pH的变化判断,方法为:将pH=1的HA溶液1mL稀释至100mL,其pH<3,证明HA为弱酸,
故答案为:A、B、E;将pH=1的HA溶液1mL稀释至100mL,其pH<3(或用pH试纸测得NaA溶液的pH>7);
(2)由于次氯酸钠中的次氯酸根离子水解,结合了水电离的氢离子,导致溶液中的氢氧根离子浓度增大,溶液显示碱性,次氯酸根离子水解方程式为:ClO-+H2O?HClO+OH-,醋酸钠溶液中存在的离子有:Na+、ClO-、H+、OH-、HClO、H2O,
故答案为:碱;ClO-水解使溶液显碱性:ClO-+H2O?HClO+OH-;Na+、ClO-、H+、OH-、HClO、H2O.
B.pH=2的HA溶液和pH=12的NaOH溶液等体积混合,测混合后溶液的pH<7,说明混合后溶液显示酸性,证明了pH=2的HA溶液中,HA浓度大于0.01mol/L,HA部分电离,属于弱酸,故B正确;
C.HA与Na2CO3溶液反应生成CO2,只能说明酸性HA的大于碳酸的酸性,不能判断HA是否属于弱酸,故C错误;
D.向HA溶液中加一定量的NaOH溶液到恰好呈中性,溶液中c(Na+)=c(A-),属于酸碱中和反应,不能判断HA是否属于弱酸,故D错误;
E.pH相同的盐酸和HA溶液,与Zn反应产生等体积氢气时HA溶液所需时间较短,说明反应过程中,HA能够电离出氢离子,证明了HA在原溶液中部分电离,所以HA属于弱酸,故E正确;
可以通过稀释AH溶液,根据pH的变化判断,方法为:将pH=1的HA溶液1mL稀释至100mL,其pH<3,证明HA为弱酸,
故答案为:A、B、E;将pH=1的HA溶液1mL稀释至100mL,其pH<3(或用pH试纸测得NaA溶液的pH>7);
(2)由于次氯酸钠中的次氯酸根离子水解,结合了水电离的氢离子,导致溶液中的氢氧根离子浓度增大,溶液显示碱性,次氯酸根离子水解方程式为:ClO-+H2O?HClO+OH-,醋酸钠溶液中存在的离子有:Na+、ClO-、H+、OH-、HClO、H2O,
故答案为:碱;ClO-水解使溶液显碱性:ClO-+H2O?HClO+OH-;Na+、ClO-、H+、OH-、HClO、H2O.
点评:本题考查了弱酸的判断及盐的水解,注重了基础知识的考查,可以根据所学知识分析,注意次氯酸钠溶液中存在的粒子,除了钠离子、氢氧根离子、次氯酸根离子、次氯酸,含有水及水电离的氢离子,本题难度不大.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
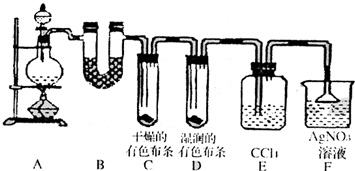 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.