题目内容
9.把m mol C2H4和n mol氢气混合于密闭容器中,在适当的条件下生成了p mol C2H6,若将所得的混合气体完全燃烧生成二氧化碳和水,则需氧气( )| A. | 3.5p mol | B. | (3m+n/2)mol | C. | (3m+n)mol | D. | (3m+n/2-3 p)mol |
分析 根据原子守恒可知,反应后混合气体的耗氧量即是m molC2H4和n molH2燃烧的耗氧量,反应物为CO2和H2O,根据C原子、H原子守恒计算出CO2和H2O的物质的量,再根据O原子守恒计算消耗的氧气物质的量.
解答 解:反应前后C原子和H原子的物质的量没有发生变化,则混合气体的耗氧量即是m molC2H4和n molH2的耗氧量,根据碳原子守恒n(CO2)=2n(C2H4)=2m mol,根据H原子守恒n(H2O)=2n(C2H4)+n(H2)=(2m+n)mol,
根据O原子守恒,则2n(O2)=2n(CO2)+n(H2O)=4m mol+(2m+n)mol=(6m+n)mol,
则消耗的氧气的物质的量n(O2)=(3m+0.5n)mol,
故选B.
点评 本题考查混合物的计算,题目难度不大,关键清楚反应后混合气体的耗氧量即是m molC2H4和n molH2燃烧的耗氧量.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
12.下列数量的物质中含原子个数最多的是( )
| A. | 0.4mol氧气 | B. | 4℃时,5.4mLH2O | ||
| C. | 标准状况下5.6L二氧化碳 | D. | 10g氖 |
17.实验室配制500mL浓度为2mol/L的NaOH溶液.选用容量瓶的规格和所需NaOH的质量分别为( )
| A. | 100 ml 容量瓶、40 g | B. | 500 ml 容量瓶、40 g | ||
| C. | 100 ml 容量瓶、80 g | D. | 500 ml 容量瓶、80 g |
4.某化学兴趣小组用图所示装置制备干燥纯净的氯气,并探究氯气的性质.请回答下列问题:
(1)A中盛有浓盐酸,B中盛有MnO2,则烧瓶中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;若用200mL10mol•L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化氢挥发),则产生氯气的物质的量为小于0.5mol(选填“大于”、“小于”、“等于”).
(2)兴趣小组的同学准备在F中装入FeCl2溶液以验证Cl2的氧化性,则该反应的化学方程式2FeCl2+3Cl2=2FeCl3.
(3)兴趣小组同学一致认为氯气能使湿润的红色布条褪色,但对于使湿润的红色布条褪色的原因看法不一致,为探究原因,特设计下列实验.(已知:Cl2+H2O?HCl+HClO)
(4)兴趣小组的某同学认为整套实验装置还存在一处明显缺陷,该缺陷是缺乏尾气处理装置.

(1)A中盛有浓盐酸,B中盛有MnO2,则烧瓶中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;若用200mL10mol•L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化氢挥发),则产生氯气的物质的量为小于0.5mol(选填“大于”、“小于”、“等于”).
(2)兴趣小组的同学准备在F中装入FeCl2溶液以验证Cl2的氧化性,则该反应的化学方程式2FeCl2+3Cl2=2FeCl3.
(3)兴趣小组同学一致认为氯气能使湿润的红色布条褪色,但对于使湿润的红色布条褪色的原因看法不一致,为探究原因,特设计下列实验.(已知:Cl2+H2O?HCl+HClO)
| 提出假设 | 验证假设 | 得出结论 |
| ①能使红色布条褪色是HCl ②能使红色布条褪色是HClO ③能使红色布条褪色是Cl2(写化学式) | 实验①:把红色布条伸入稀盐酸中,红色布条不褪色. 实验②:E、F分别装入A(填标号),干燥的红色布条不褪色,湿润的红色布条褪色. A.干燥的红色布条、湿润的红色布条 B.湿润的红色布条、干燥的红色布条 | 氯水中的HClO (写化学式)能使湿润的红色布条褪色. |

14.下列各组物质,化学键类型相同、晶体类型相同且熔化时破坏作用力类型也相同的( )
| A. | HCl KCl | B. | CO2 SiO2 | C. | NH4Cl CCl4 | D. | NaOH Na2O2 |
1.用酒精加热下列各物质,有单质生成的是( )
| A. | 浓HNO3 | B. | NaHCO3 | C. | NH4Cl | D. | Fe(OH)3 |
18.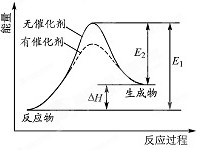 某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )
 某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 催化剂能降低反应的活化能 | |
| C. | 催化剂能改变反应的焓变 | |
| D. | 逆反应的活化能大于正反应的活化能 |
19.2008年9月25日晚9时10分,我国“神舟七号”载人飞船顺利升入太空.此次火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R+2N2O4═3N2↑+4H2O↑+2CO2↑,下列叙述错误的是( )
| A. | 此反应是氧化还原反应 | |
| B. | 反应瞬间产生大量高温气体,推动火箭飞行 | |
| C. | 在反应中N2O4做还原剂 | |
| D. | R的分子式为C2H8N2 |